L'équipe de Benoit Vanhollebeke, de l'Institut des Neurosciences de l'Université de Bruxelles ( ULB ) publie un second article dans le prestigieux journal Science ( après celui de 2018 ) sur les mécanismes de protection et de réparation de la barrière isolant le cerveau, et sur des approches thérapeutiques qui pourraient protéger notre cerveau de maladies neurodégénératives, telles que sclérose en plaques, Alzheimer, Parkinson, démence à corps de Léwy, ou encore AVC ou tumeurs.
Notre maison est l'endroit où la majorité de nos activités vitales se déroulent. Nous tenons à ce qu'elle soit solide et particulièrement bien isolée. Le murs qui l'entourent doivent donc être de la meilleure qualité possible. Néanmoins, il est important d'y aménager des fenêtres pour maintenir un contact avec l'extérieur. Fenêtres que nous pouvons ouvrir quand nécessaire, pour faire entrer de l'air frais ou expulser les mauvaises odeurs. De même, les portes donnant sur l'extérieur permettent de faire entrer les personnes nécessaires ou de leur permettre de sortir quand le moment est venu. Mais ces portes et ces fenêtres, nous les maintiendront closes autant que nécessaire pour conserver la chaleur à l'intérieur.
Mais si par malheur un camion venait à percuter la façade, et que celle-ci se lézarde, cela peut conduire à la catastrophe, immédiatement ou à long terme, et nous prendrons au plus vite les actions nécessaires pour réparer afin que l'étanchéité soit restaurée, ou, plus grave, pour que l'ensemble ne risque pas de s'écrouler.
Notre cerveau ne pèse que 2% de notre poids total, mais consomme 20% de l'énergie de notre corps. Cette énergie, principalement l'oxygène, est fournie par l'extérieur via le sang. Aussi, beaucoup de substances de notre cerveau, et les réactions biochimiques auxquelles elles participent sont uniques de cet organe. Il est crucial de maintenir leur intégrité et de les empêcher de s'échapper vers l'extérieur. De même un apport excédentaire de ces mêmes substances via le sang, pourrait être nuisible, ainsi bien entendu que l'entrée de substances qui seraient toxiques pour les cellules du cerveau telles que les neurones et les astrocytes.
Le cerveau est donc un organe très particulièrement isolé, et les entrées et sorties de substances y sont rigoureusement contrôlées. Ceci grâce à un agencement très particulier des cellules endothéliales constitutives de la paroi des vaisseaux sanguins qui irriguent le cerveau.
Contrairement aux cellules endothéliales des autres vaisseaux sanguins, entre lesquelles, il existe un faible interstice, mais suffisant pour y permettre la diffusion de petites molécules, les cellules endothéliales des vaisseaux sanguins du cerveau sont accolées les unes aux autres par des jonctions très étroites ("tight junctions" en anglais) qui empêchent ce type de diffusion. C'est ce qu'on appelle la barrière hémato-encéphalique, ou "blood-brain barrier (BBB)" en anglais. Certaines protéines relient deux cellules endothéliales voisines comme des fils à coudre qui attacheraient deux pièces de vêtement, comme l'illustre la figure ci-dessous, dans laquelle un zoom est effectué progressivement, dans le sens des aiguilles d'une montre, sur la jonction entre deux cellules endothéliales. On y voit que des cellules du cerveau appelées "astrocytes" viennent compléter cette étanchéité, et que les neurones en contact avec les vaisseaux sanguins sont reliés à ces astrocytes par un espace synaptique, similaire à la synapse qui se trouve à la jointure entre deux neurones communiquant entre eux.
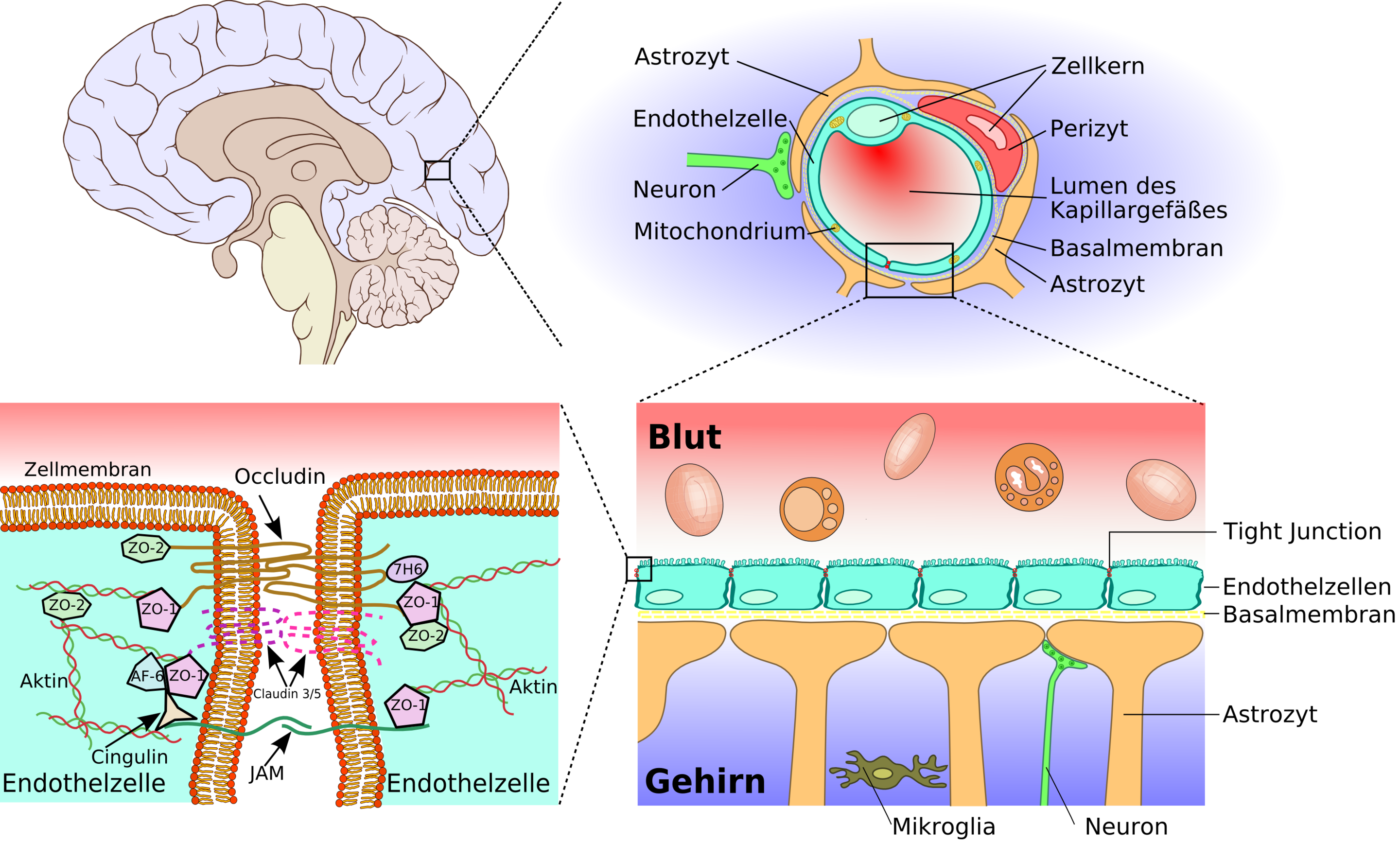
Le cerveau n'est cependant pas entièrement isolé de l'extérieur, car des mécanismes contrôlés permettent le passage de certaines molécules du sang vers le cerveau ou dans le sens inverse.
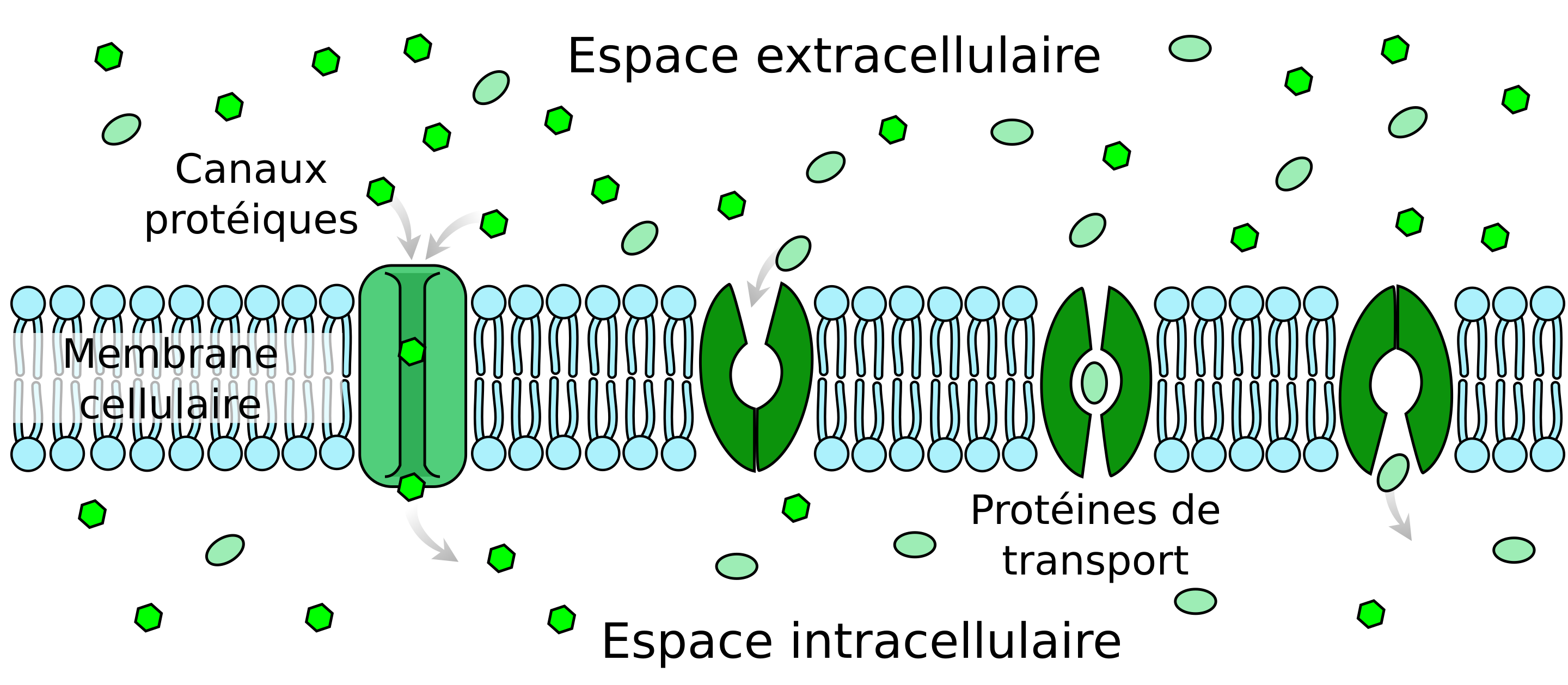
- certaines petites molécules apolaires, solubles dans les graisses (lipophyles) peuvent s'infiltrer dans la bicouche de phospholipides de la paroi des cellules endothéliales. Des phospholipides s'écartent et laissent s'infiltrer ces molécules.
- Une variété de petits canaux formés de protéines sont spécifiques de certaines molécules polaires (hydrophiles) et s'ouvrent pour laisser passer ces molécules quand leur apport est nécessaire. L'eau, par exemple, est échangée avec le cerveau par ce mécanisme.
- Toute une série de petites molécules trop peu lipophiles pour pouvoir diffuser entre les phospholipides sont transportées au travers des parois des cellules endothéliales grâce à des stuctures formées de protéines, mais qui contrairement aux canaux, ne sont pas passifs, mais s'ouvrent vers l'extérieur pour capter la molécule, puis la transporte vers l'intérieur. Ces transporteurs sont nécessaires pour des molécules telles que le glucose ou certains acides aminés.
- Pour assurer le passage de plus grosses molécules, la paroi cellulaire se déforme en une vésicule entourant la molécule à faire pénétrer (endocytose). Ces vésicules migrent vers la paroi opposée de la cellule, où le même processus se reproduit (transcytose). L'insuline pénètre ainsi dans le cerveau, ou encore les molécules de LDL nécessaires au transport du cholestérol, lequel est directement fabriqué dans les astrocytes du cerveau.
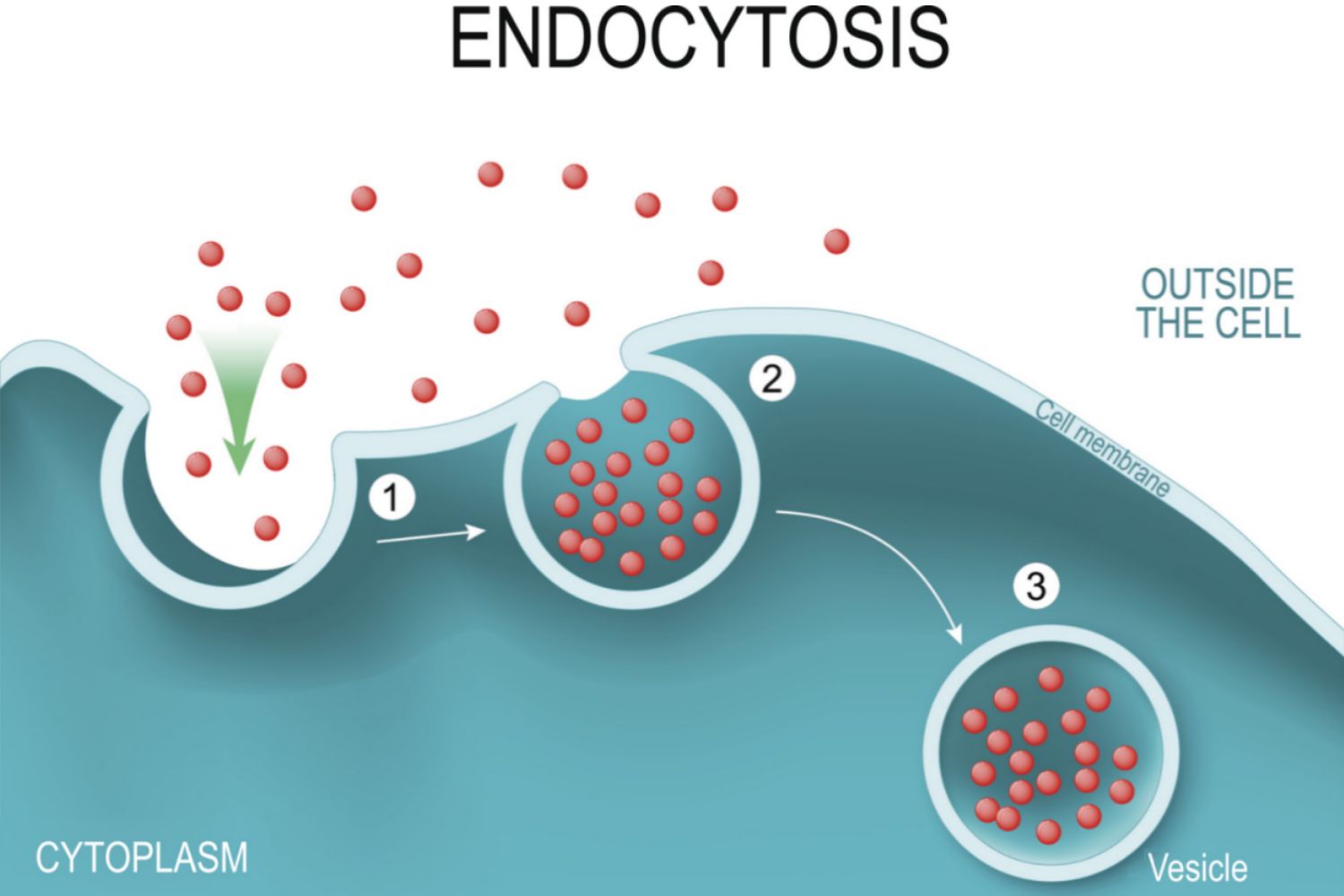
Il est donc impératif que cette barrière demeure intacte. Que son homéostase, c'est à dire l'équilibre de son fonctionnement, y soit protégée. Or, différents événements peuvent venir la perturber plus ou moins gravement. Notamment les traumatismes craniens ou les AVC, mais aussi l'exposition à certaines toxines présentes dans l'environnement. Même certains virus ou bactéries peuvent nuire à l'intégrité de la barrière hémato-encéphalique, soit directement, soit en activant des éléments de notre système immunitaire qui peuvent se retourner contre cette barrière dans des processus auto-immuns. C'est par exemple ce qui semble être une des causes de la sclérose en plaque.
Si la barrière hémato-encéphalique devient poreuse à certains endroits, voire y est complètement altérée, c'est évidemment la porte ouverte à l'entrée de produits indésirables dans le cerveau. Des produits toxiques pour le cerveau, qu'ils proviennent de l'environnement ou même des substances naturellement synthétisées par notre organisme. Ainsi par exemple, certains acides aminés naturels sont excitateurs pour nos neurones, et leur concentration doit y être strictement contrôlée.
Voyons donc comment est assurée l'homéostase, c'est à dire l'équilibre du fonctionnement, d'une cellule, car ceci constitue la base des travaux de recherche de l'équipe de Benoit Vanhollebeke. Elle est assurée par une signalisation cellulaire. Une signalisation cellulaire consiste en la transmission d'une ou plusieurs molécules d'une cellule à l'autre de façon à engendrer chez la cellule receptrice une série de réactions qui vont stimuler l'expression des gènes nécessaires au bon fonctionnement de ce type particulier de cellule. Ces voies de signalisation peuvent se faire à courte distance, entre cellules adjacentes, tels que les neurotransmetteurs secrétés par un neurone au niveau de l'espace synaptique pour aller se fixer à un récepteur du neurone situé de l'autre côté de la synapse, enclanchant ainsi l'action appropriée de ce neurone. Cela peut aussi se faire à distance. Les hormones sont des facteurs de signalisation de ce type. L'insuline, secrétée par le pancréas pour réguler le métabolisme du glucose dans les autres cellules de l'organisme, en est un exemple.
L'homéostase cellulaire, ainsi d'ailleurs que l'embryogenèse, c'est à dire la différentiation des cellules de l'oeuf initial en cellules spécifiques des différents organes, s'effectue grâce à un ensemble de voies de signalisation très anciennes, qu'on retrouve dès que les organismes pluricellulaires se sont développés. Cette signalisation est effectuée par des glycoprotéines appelées Wnt (prononcer "winnt") allant se fixer sur certains recepteurs situés sur les parois cellulaires, appelés Frizzled (Fz). Lorsqu'une protéine Wnt se fixe à un récepteur Fz, il se produit à l'intérieur de la cellule, une série de réactions biochimiques qui vont, en final, empêcher une protéine appelée ß-caténine de se lier à un phosphate (phosphorylation). En ne se liant pas à un phosphate, la ß-caténine ne peut plus se lier à l'ubiquitine, qui est la protéine responsable de la dégradation des protéines intracellulaires, en vue de les éliminer et donc d'empêcher de jouer leur rôle quand celui-ci n'est pas nécessaire. La ß-caténine non phosphorylée peut entrer alors dans le noyau de la cellule. Elle va alors interagir avec une série de facteurs de transcription spécifiques du type de cellule concernée. Ces facteurs de transcription, comme leur nom l'indique, vont activer un certains nombres de gènes, les transcrire en ARN messagers correspondants, lesquels iront fabriquer les protéines nécessaires au bon fonctionnement de la cellule. Les perturbations de la signalisation par les glycoprotéines Wnt peuvent donc conduire à des dysfonctionnements graves dans des cellules et notamment conduire à des cancers.
Au cours de l'évolution, les types de facteurs Wnt se sont multipliés ainsi que le nombre de récepteurs Fz. Chez les vertébrés, on compte 19 gènes très semblables de facteurs Wnt et 10 gènes de récepteurs Frizzled (Fz). Les Wnt coimportent une partie de leur structure très conservée etre les différents sous-types. Il en est bien sûr de même pour les Fz. Et donc, in vitro, il y a une grande compatibilité entre différents Wnt et différents Fz, ce qui ne permet donc pas d'expliquer une spécificité du signal qui sera transmis à un certain type de cellule.
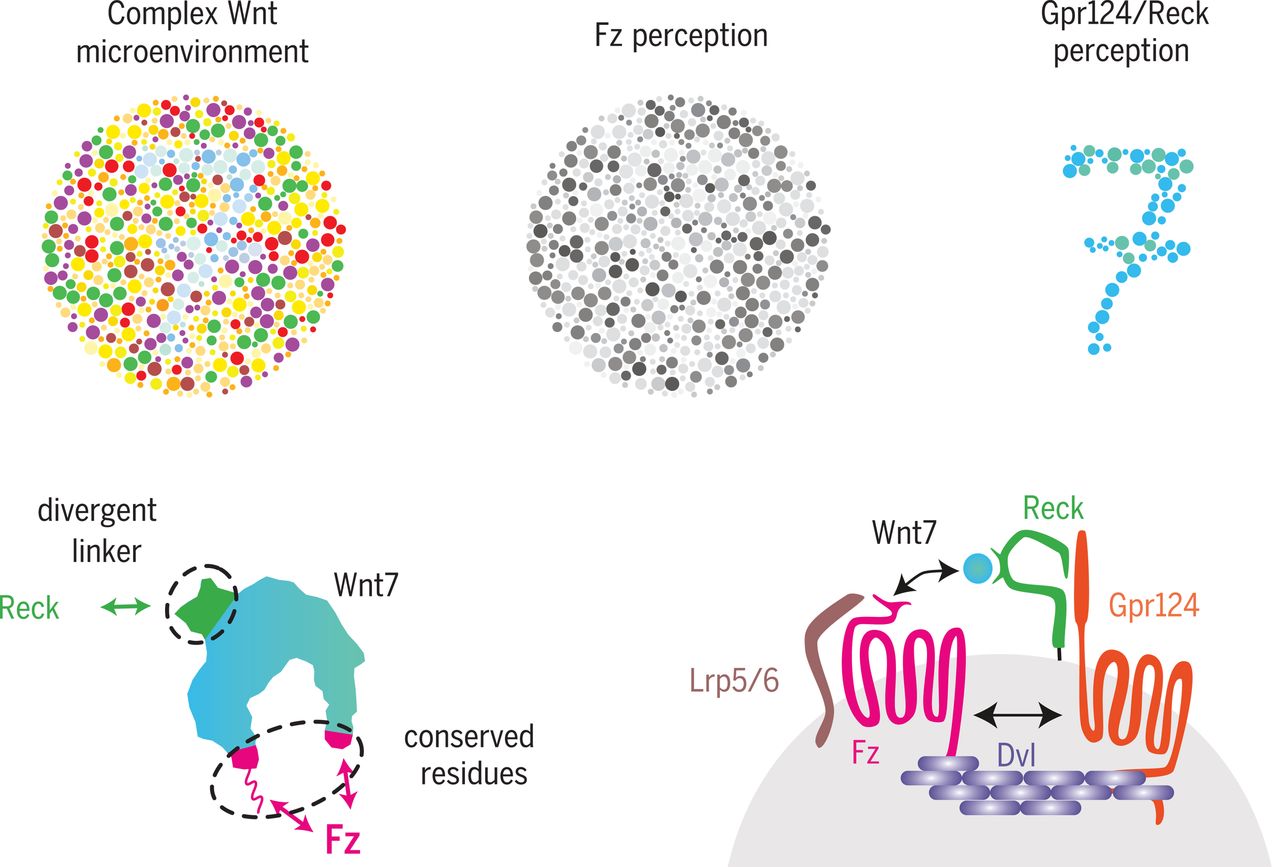
Il est maintenant bien établi que les différents types de cellules possèdent un autre récepteur à proximité du récepteur Fz, et que ce récepteur est sélectif pour la partie non conservée des différents Wnt (c.a.d. la partie qui de laa protéine qui diffère d'un Wnt à l'autre). Ce sont ces autres récepteurs qui vont d'abord fixer le Wnt spécifique au signal à communiquer à la cellule dans la membrane desquelles ils sont fixés, pour ensuite présenter la partie conservée du Wnt au récepteur Fz situé à proximité.
Dans leur article publié dans Science en 2018, l'équipe de Benoit Vanhollebeke ont montré que le Wnt7 qui est la glycoprotéine responsable de la voie de signalement au niveau des cellules endotheliales de la barrière hémato-encéphalique, se liait à un complexe de deux protéines : la protéine Reck, qui possède un site de reconnaissance de la partie hautement divergente de Wnt7 (la partie rendant ce Wnt très reconnaissable des autres membres du groupe). Cette proteine Reck est elle-même associée à une autre protéine transmembranaire Gpr124. Gpr124 d'une part, et le récepteur Frizzeld (Fz) d'autre part, sont tous deux connectés, du côté intracellulaire à des polymères de protéines appelées "Dishevelled" (Dvl), qui sont les protéines qui vont induire la suite de mécanismes intracellulaires conduisant à bloquer la phosphorylation de la ß-caténine, et donc lui permettre d'activer les différents gènes nécessaires à l'homéostase des cellules endothéliales du cerveau.
Venons-en maintenant à l'article récent, publié en févier 2022, également dans Science. Avant toute chose, il nous faut préciser ce que sont un agoniste et un antagoniste d'un produit naturellement présent dans l'organisme, et dont la fonction est de se lier à un récepteur membranaire pour déclencher un signal dans une cellule. À titre d'exemple, il existe un léger espace entre deux neurones successifs, la synapse. Des substances sont relarguées par le neurone en amont quand celui-ci a été activé par un neurone précédent. Ces substances traverses l'espace synaptique et vont se fixer à des récepteurs qui leur sont spécifiques sur le neurone en aval, ce qui enclenchera l'activation de ce neurone, et ainsi de suite. Ces substances portent d'ailleurs un nom générique bien connu : ce sont des neurotransmetteurs. Parmi les neurotransmetteurs, les trois les plus connus car les plus utilisés par les neurones, sont la noradrénaline, la sérotonine et la dopamine. Prenons la dopamine à titre d'exemple. Une substance apparentée à la dopamine et qui serait administrée à un être humain soit en tant que médicament, en tant que drogue, ou simplement en tant que toxine, et qui réussirait à franchir la barrière hémato-encéphalique pourrait avoir la possibilité de se lier à un récepteur post-synaptique de la dopamine (sur le neurone en aval de la synapse) à la place de la dopamine. Si cette substance provoque également l'activation du neurone, comme le fait la dopamine, on parlera d'un agoniste de la dopamine. Si au contraire, cette substance se lie, mais ne provoque pas l'activation du neurone, cette substance inhibe l'action de la dopamine en prenant sa place. On parle alors d'un antagoniste de la dopamine. Ainsi l'apomorphine, qui est utilisée dans le traitement de la maladie de Parkinson, est un agoniste de la dopamine. Par ailleurs, des antagonistes de la dopamine, appelés aussi antidopaminergiques, sont utilisés comme neuroleptiques s'ils bloquent spécifiquement le récepteur D2 de la dopamine. Ils servent de traitement aux psychoses telles que la schizophrénie. L'halopéridol est un exemple d'antagoniste des récepteurs D2 de la dopamine.
L'équipe de l'ULB a synthétisé des protéines ne conservant que la partie hautement différenciée de Wnt7, qui se lie au récepteur qui lui est spécifique sur la protéine Reck, tout en conservant la possibilité de Wnt de se lier à son récepteur Fz. Ils ont montré que ces agonistes de Reck n'inhibaient pas le développement de poissons zèbres ou d'amphibiens Xenopus, deux modèles animaux communément utilisés en laboratoire, ni le développement du cerveau de souris au stade néonatal, montrant ainsi l'absence d'effet indésirable, qui pourraient être liés à la perturbation du signalement par Wnt. Et surtout, ils ont montré que ces agonistes de Reck permettaient de restaurer les cellules endothéliales détruites de la barrière hémato-encéphalique chez des souris atteintes de tumeurs cérébrales ou ayant subi un accident cérébral ischémique.
Ces résultats sont bien évidemment très préliminaires, mais ils ouvrent la voie à une toute nouvelle approche thérapeutique, très prometteuse, des pathologies liées à la rupture de l'intégrité de la barrière hémato-encéphalique, qui incluent l'AVC, la sclérose en plaques, l'épilepsie et toutes les maladies neurodégénératives, telles que la maladie d'Alzheimer, la maladie de Parkinson, ou la moins connue mais encore plus pénible démence à corps de Léwy.