Thérapie ciblée chez les patients atteints du syndrome de prolifération cellulaire lié au gène PIK3CA (PROS)
Grâce à ses connaissances en biologie cellulaire, le Dr. Guillaume Canaud, professeur à l’hôpital Necker Enfants Malades, détourne un médicament anticancéreux de son indication thérapeutique première, pour soigner un ensemble de maladies somatiques très rares, très invalidantes, et limitant grandement l’espérance de vie, rassemblées sous l’acronyme commun de PROS.
Nos cellules sont pour la plupart du temps, dans un état de repos. On dit qu’elles sont « quiescentes ». Elles fabriquent au ralenti les substances nécessaires à leur fonctionnement. Cela consiste essentiellement à fabriquer les protéines, les sucres et les lipides nécessaires à leur fonctionnement et à produire l’énergie nécessaire. Les protéines sont fabriquées sur base du code génétique contenu dans un gène de l’ADN. Celui si est contenu dans le noyau, et l’information est transmise aux ribosomes, présents eux dans le reticulum endoblastique, par l’intermédiaire d’ARN messagers. Quant à l’énergie des cellules, produites en grande partie par le métabolisme du glucose, il a lieu dans des organelles appelées mitochondries. Les déchets cellulaires sont eux traités par les lysosomes et évacués vers l’extérieur via des vacuoles qui se fondent dans la membrane cellulaire. Les échanges avec l’extérieur se font via des canaux situées dans la paroi membranaire (= membrane cellulaire) ou via des récepteurs trans-membranaires sur lesquels se fixent des molécules extérieures, et qui activent une modification de la partie interne du récepteur. Et pendant la plus grande partie du temps, cela se fait à bas bruit.
La reproduction cellulaire
Mais certains événements nécessitent que des cellules se reproduisent, se multiplient. Et ceci lors de processus qui ne sont pas du tout pathologiques. Par exemple, lors de la croissance d’un enfant, ou lors de la réparation d’un tissu blessé, ou encore dans certains tissus comme l’épiderme, qui naturellement produisent des cellules mortes qui desquament et qui sont remplacées continuellement. Ou encore, au cours du développement in-utero de l’embryon, la simple morula d’abord, puis au cours de la différentiation cellulaire, de la gastrulation à l’organogenèse et à la croissance foetale.
Il est bien évident qu’à part peut-être dans la phase morula de l’embryon, une cellule ne se réplique pas seule, mais que plusieurs, voire de nombreuses cellules d’un tissu doivent se répliquer en même temps, comme par exemple lorsqu’une lésion tissulaire doit être réparée. Le signal déclenchant la réplication cellulaire vient donc de l’extérieur. À ce moment, la cellule quitte sa phase de quiescence, parfois aussi appelée phase G0 pour entrer dans un cycle de division cellulaire.
La division cellulaire
Ce cycle comprend deux phases, l’interphase et la mitose. Pendant l’interphase, la cellule grossit et prépare tout le matériel nécessaire à se répliquer et se diviser. La mitose est la division cellulaire proprement dite.
L’interphase se divise elle-même en trois phase :
La phase G1 (de l’anglais « Gap ») pendant laquelle la cellule commence à grossir, à augmenter la quantité de ses protéines qui seront nécessaires pour dupliquer toutes ses organelles, mais aussi les différents enzymes qui entreront dans la réplication de l’ADN. Dans le même temps, le métabolisme du glucose est activé pour produire l’énergie nécessaire à cette surproduction de matériel cellulaire.
La phase S (pour « Synthèse ») : la cellule ayant mis en place tous ses outils nécessaires à la division cellulaire, l’ADN est répliqué et les chromosomes sont dupliqués.
Pendant le phase G2 enfin, la cellule continue à grandir, à produire de nouvelles organelles, et surtout réarrange ses constituants pour se préparer à la mitose.
La mitose (M) est la phase de division, chaque nouvelle cellule emportant la moitié des chromosomes qui ont été dédoublés. La mitose elle-même se divise en plusieurs phases, mais nous n’entrerons pas ici dans le détail.
La mitose est une phase qui dure 1 à 2 heures. Le cycle complet prend environ 24h.
Le cycle cellulaire ainsi terminé, trois choses peuvent se produire :
Soit les cellules continuent à se répliquer et entrent dans un nouveau cycle de division cellulaire.
Soit la division cellulaire s’arrête et les nouvelles cellules retrouvent leur état de quiescence G0
Soit, la réplication de l’ADN s’est faite avec trop d’erreurs que les enzymes de réparation ne peuvent corriger, et la cellule est alors programmée pour mourir. Cette mort cellulaire est appelée « apoptose » et est un processus naturel et non pathologique.
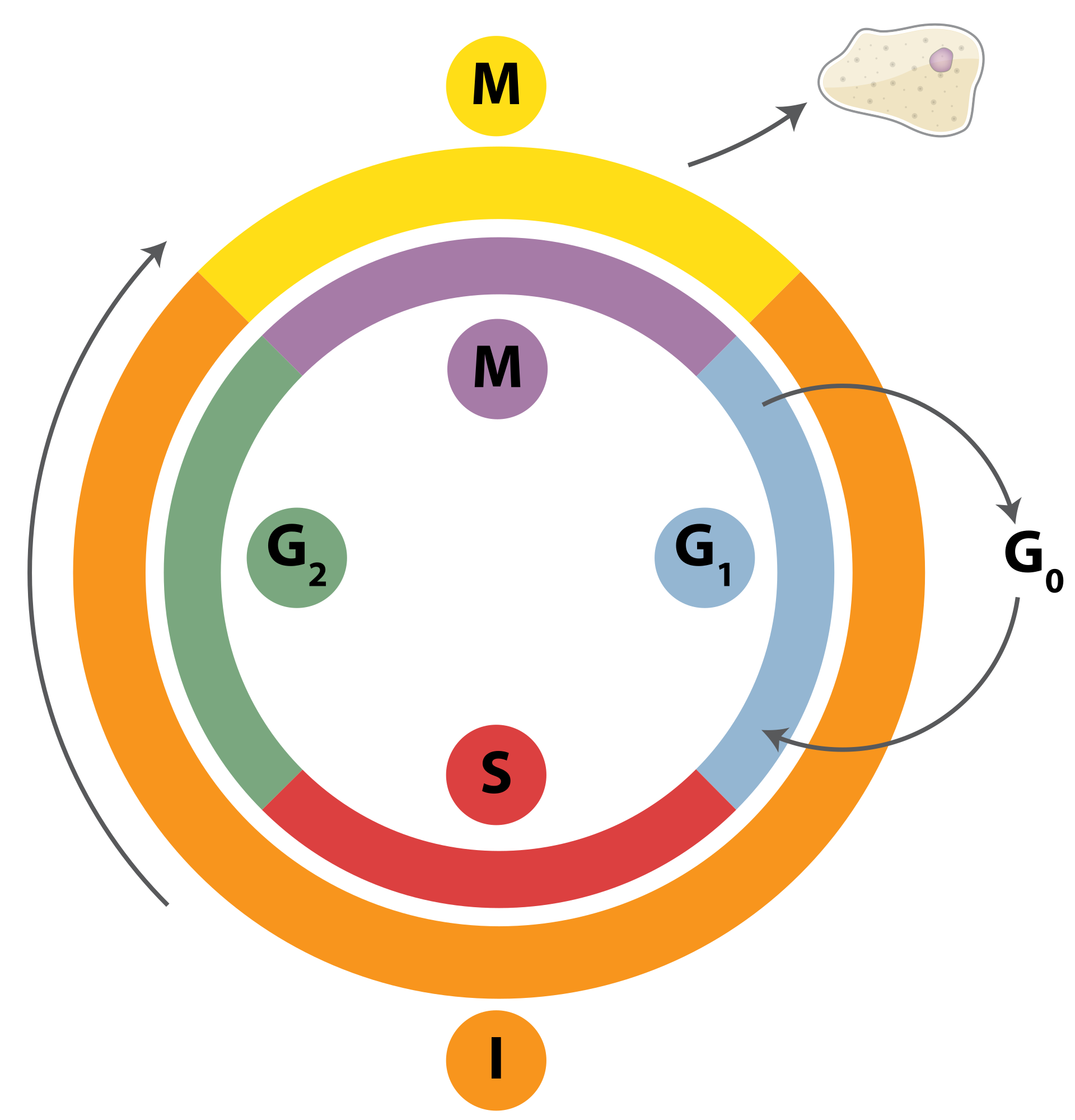
Cycle de division cellulaire. I est l'interphase et M, la mitose
Les voies de signalisation
Pour activer ces différents processus et les synchroniser, les cellules utilisent différentes molécules communiquant entre elles de proche en proche, depuis le point lançant le signal jusque’aux mécanismes cellulaires qui doivent être activés (ou inhibés, quand il y a lieu de stopper le mécanisme mis en action). Ces molécules sont pour la plupart du temps des enzymes, c’est à dire des protéines servant d’outils pour catalyser des réactions biochimiques. Et ces enzymes sont presqu’exclusivement des kinases, c’est à dire des enzymes auxquelles peuvent s’accrocher des groupements phosphates (on parle de « phosphorylation ») ou au contraire décrocher des groupements phosphates qui y étaient attachés (on parle de « déphosphorylation »). La phosphorylation des kinases peut soit les activer, soit les désactiver. Il n’y a pas de règle générale. Mais une fois activée, la kinase va activer elle-même d’autres mécanismes. Soit d’autres kinases d’une chaîne de réactions enzymatiques, soit le déclenchement de l’activité d’une fonction cellulaire, comme le métabolisme du glucose ou la réplication de l’ADN, par exemple.
Ce transfert d’information via une série de kinases, ou parfois via d’autres messagers, est appelée « voie de signalisation ». Ces voies de signalisation joue un rôle crucial dans le fonctionnement d’une cellule, mais aussi dans le fonctionnement d’un groupe de cellules, ou dans la communication d’un organe vers un autre (dans ce dernier cas, les agents de signalisation extérieurs sont des hormones, telles que l’insuline).
Beaucoup de cancers sont provoqués par des altérations de ces voies de signalisation intracellulaires.
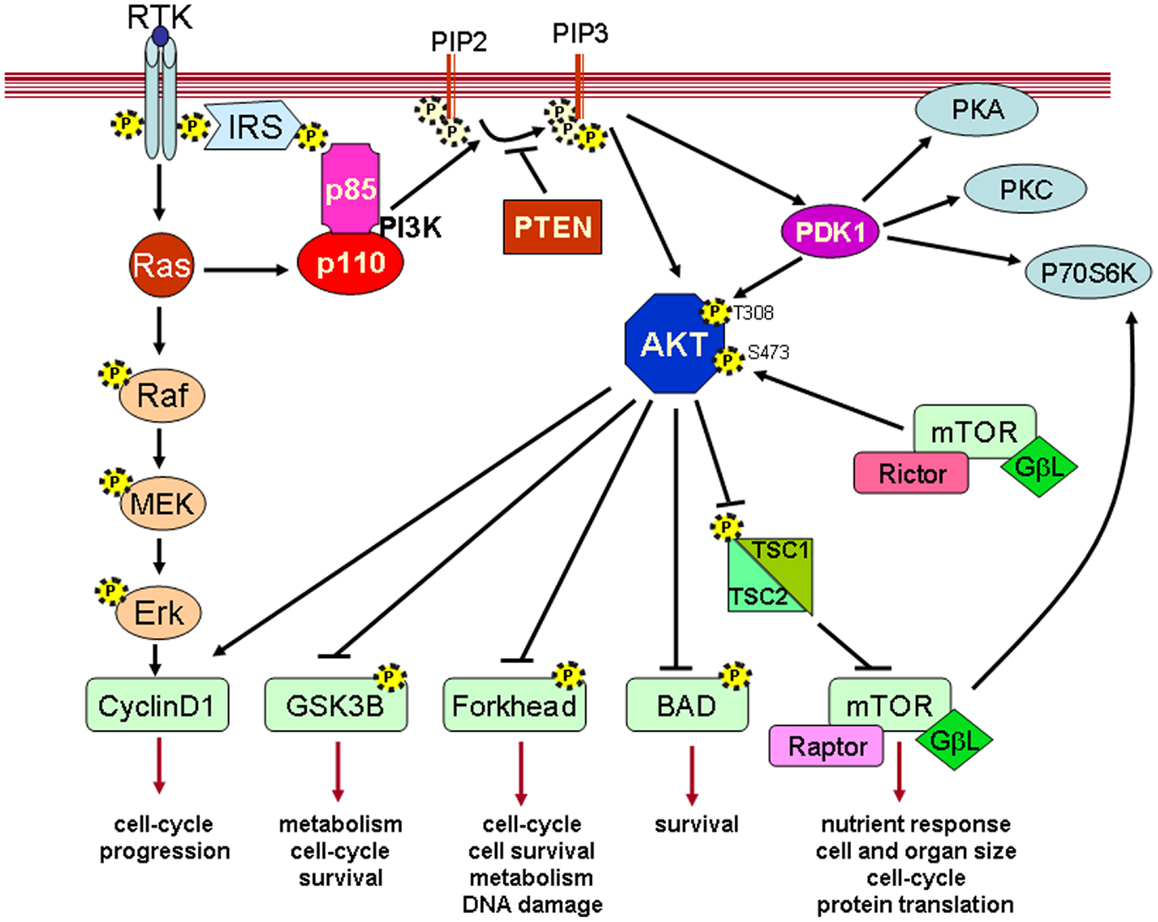
Parmi les nombreuses kinases qui participent aux voies de signalisation, il en est une qui joue un rôle central. On la désigne sous le terme d’Akt. Cette kinase peut être doublement phosphorylée (ajout de deux groupements phosphate), et lorsqu’elle est diphosphorylée, elle est activée et peut à son tour interagir avec de très nombreux substrats cellulaires (une centaine) et notamment booster la synthèse d’ADN, la synthèse de protéines via l’activation du complexe mTORC1 (qui signifie « mammalian target of rapamycin complex 1 », le métabolisme du glucose, initier le cycle cellulaire en vue de la division de la cellule et de la prolifération cellulaire. Akt inhibe également l’apoptose, c’est-à-dire la mort cellulaire programmée.
Comment Akt, cette kinase importante, est-elle elle-même activée ? Elle possède comme plusieurs autres enzymes, un domaine de sa structure moléculaire qu’on appelle « domaine PH », qui permet de se lier à une molécule d’un sucre particulier, l’inositol, fixé à la membrane plasmatique lipidique par un groupement phosphate, quand celui-ci porte trois groupements phosphate supplémentaires. En abrégé, on appelle cette molécule PIP3, pour « phosphatidyl-inositol (3,4,5)-triphosphate ». Nous l’appellerons simplement PIP3.
Lié ainsi à PIP3 par son domaine PH, Akt se fait phosphoryler en deux endroits, les deux phosphates venant de deux sources différentes, mais nous n’entrerons pas dans ces détails.
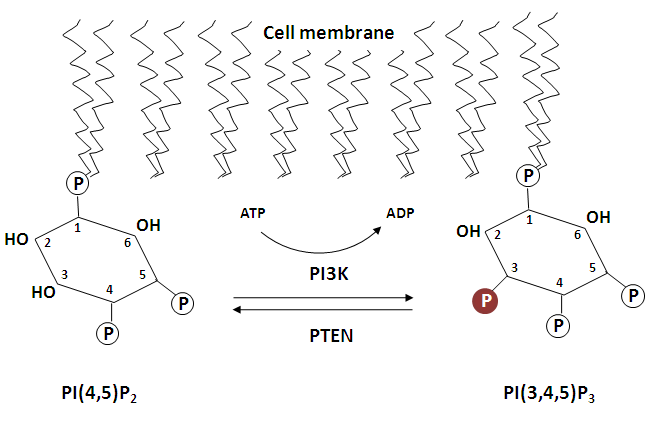
Bien entendu, PIP3 ne peut pas rester présent en permanence au niveau de la membrane plasmatique. Sinon, il continuerait sans cesse à activer Akt, et les cellules ne cesseraient de se diviser et se répliquer. Quand la division cellulaire doit s’arrêter, il faut que PIP3 se désactive. Cela se fait en lui ôtant un de ses groupes phosphate, celui en position 3. C’est bien évidemment une enzyme qui s’occupe de cela le moment venu, enzyme qui sera activée par une autre branche des voies de signalisation. Cette enzyme, appelée PTEN, ayant pour rôle de cliver ( = d’hydrolyser) un groupe phosphate, fait partie de la famille des phosphatases.
Le phosphatidylinositol accroché à la membrane plasmatique n’a plus alors que deux groupement phosphates pouvant se lier au domaine PH d’Akt. Il s’appelle tout logiquement PIP2 pour « phosphatidyl-inositol (4,5)-diphosphate ». PIP2 en interagissant avec le domaine PH d’Akt ne peut changer la conformation de celui-ci qui lui permettrait d’être diphosphorylé. Akt est donc rendu inactif, et PIP2 est la forme inactive correspondant à PIP3.
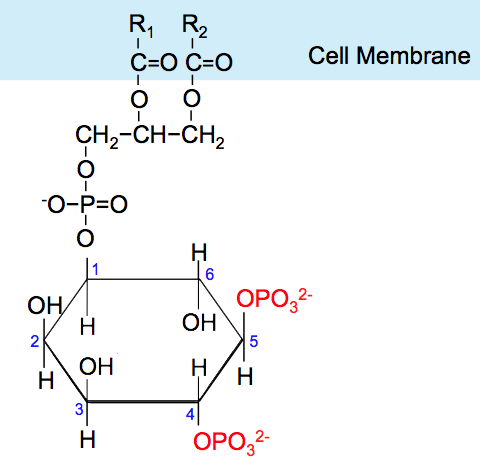
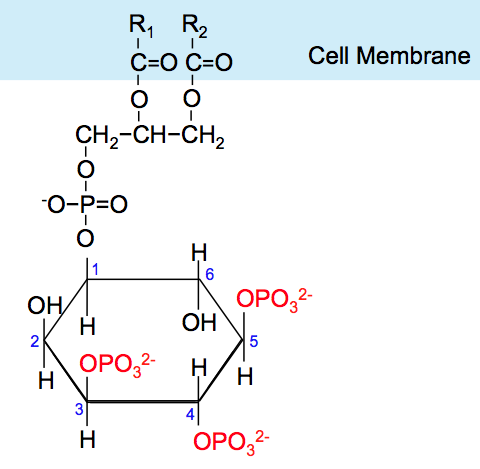
phosphatidyl-inositol (4,5)-diphosphate (PIP2) à gauche, et phosphatidyl-inositol (3,4,5)-triphosphate (PIP3) à droite
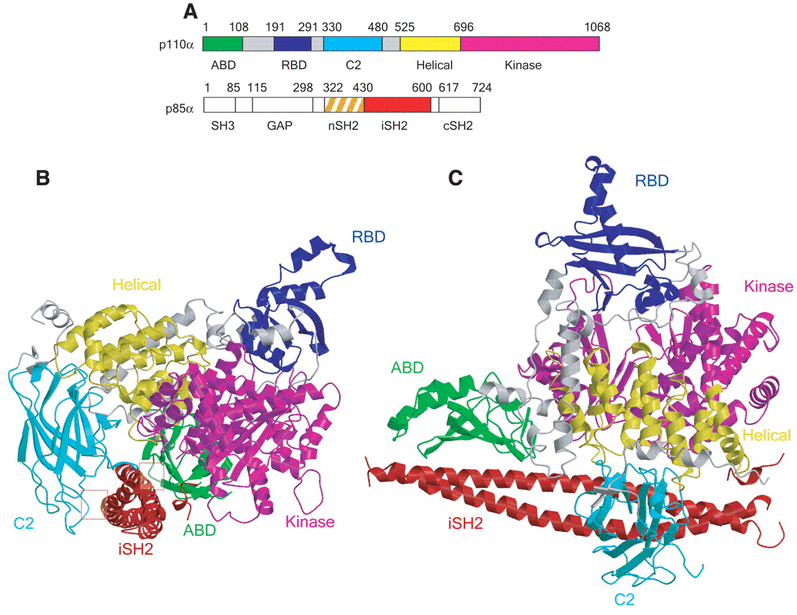
Voyons maintenant les choses en sens inverse. Lorsque Akt est inactivé, et qu’il y a lieu d’activer le cycle cellulaire, donc toutes les synthèses qui l’accompagnent, il faut que PIP2 soit phosphorylé pour passer au stade triphovphorylé PIP3. Ceci demande l’intervention d’une autre kinase qui joue un grand rôle dans cette voie de signalisation initiant le cycle cellulaire conduisant à la division de la cellule. Cette enzyme, c’est la phosphoinositide 3-kinase, communément désignée par PI3K. PI3K est un hétérodimère, c’est à dire que la protéine de cette enzyme est formée de deux sous-unités en interaction, une unité appelée p110, la plus longue des deux, est l’unité catalytique, c’est à dire que c’est l’unité qui joue le rôle de kinase, et qui permet donc de phosphoryler PIP2 en PIP3. La seconde unité est appelée p85. Elle est plus courte, et joue un rôle régulateur, comme nous le verrons plus loin.
 Chacune de ces deux sous-unités sont fabriquées à partir du code génétique contenu dans deux gènes différents. Mais en outre, l’unité catalytique p110 peut exister sous 4 formes légèrement différentes, appelées 𝜶, 𝜷, 𝜸 et 𝜹. Chacune de ces 4 formes est codée par un gène différent. Néanmoins, la forme 𝜶 est nettement prépondérante, et nous considérerons essentiellement cette forme p110𝜶 ici, et donc l’enzyme PI3K𝜶, quand on parle de l’hétérodimère.
Chacune de ces deux sous-unités sont fabriquées à partir du code génétique contenu dans deux gènes différents. Mais en outre, l’unité catalytique p110 peut exister sous 4 formes légèrement différentes, appelées 𝜶, 𝜷, 𝜸 et 𝜹. Chacune de ces 4 formes est codée par un gène différent. Néanmoins, la forme 𝜶 est nettement prépondérante, et nous considérerons essentiellement cette forme p110𝜶 ici, et donc l’enzyme PI3K𝜶, quand on parle de l’hétérodimère.
PI3K est elle-même activée par phosphorylation de sa partie catalytique p110, qui est donc la partie qui joue le rôle de kinase. Cette activation peut se faire par deux mécanismes différents. Ce qui nous conduit à décrire le récepteur trans-membranaire qui va ici entrer en jeu. Il s’agit du récepteur EGFR, pour « Epidermal Growth Factor Receptor », soit donc « Récepteur épidermique de facteur de croissance ». Ces récepteurs sont aussi parfois appelé simplement RTK, pour Récepteurs à Tyrosine Kinases. Ce sont donc les récepteurs qui interagissent avec le milieu extérieur à la cellule et qui vont être activés par des facteurs de croissance, appelés ainsi précisément parce qu’ils activent les voies de signalisation qui conduisent à la croissance de la cellule en vue de sa division.
Il existe plusieurs facteurs de croissance. Parmi ceux ayant une haute affinité pour EGFR, on trouve par exemple EGF (Epidermal Growth Factor) ou TGF𝜶 (Transforming Growth Factor 𝜶). Lorsqu’un facteur de croissance se fixe à la partie extracellulaire de EGFR, celui-ci se couple avec un autre récepteur EGFR ou un autre récepteur de sa famille. On dit qu’il se dimérise. Cette dimérisation conduit à l’activation de sa partie intracellulaire, qui contient à la partie terminale de la protéine diverses tyrosines, un type d’acide aminé qui a la possibilité de fixer un groupement phosphate. C’est précisément ce qui va se produire lors de la dimérisation suite à l’activation par un facteur de croissance : les tyrosines terminales intracellulaires vont se phosphoryler, et vont dès lors être en situation d’activer certaines enzymes. Essentiellement via deux voies.
La partie régulatrice p85 de PI3K possède un domaine appelé SH2 qui va pouvoir se fixer à la partie de EGFR comportant les tyrosines phosphorylées. De ce fait PI3K est rapprochée de la membrane plasmatique, et sa partie catalytique peut alors entrer en interaction avec PIP2 pour le transformer en PIP3.
EGFR phosphorylé peut aussi interagir par une autre voie composée de plusieurs enzymes qui au final activent une autre protéine importante dans la signalisation cellulaire : RAS. Cette protéine est liée à une guanosine diphosphate ou GDP : un des 4 nucléosides qu’on retrouve dans l’ADN, lié ici à une chaine de deux phosphates. L’activation de RAS-GDP se fait en ajoutant un troisième phosphate à la chaîne, pour devenir RAS-GTP. Cette modification permet à RAS de directement activer la partie catalytique p110 de PI3K, indépendamment de p85.
Nous avons ainsi résumé le mécanisme qui va permettre à Akt d’être activé, et que nous reprenons dans la figure ci-dessous, dans laquelle certaines protéines entrant en jeu ont été ajoutées, mais dont nous n’avons pas parlé, par soucis de simplification.
Ce sont des mutations du gène codant pour la partie catalytique de PI3K𝜶, appelé gène PI3KCA (pour domaine Catalytique alpha de PI3K) ou du gène codant pour RAS, à savoir le gène KRAS, conduisant à une suractivation de ces kinases, qu’on désigne sous le vocable de « gain de fonction », qui sont responsables de l’apparition de la toute grande majorité des cancers, car Akt restant activée, les cellules prolifèrent anormalement, et comme en plus, Akt inhibe l’apoptose, donc la mort cellulaire de cellules anormales, ces cellules anormales prolifèrent et un cancer se développe. Un facteur aggravant quand un cancer est déjà avancé, est la prolifération des récepteurs EGFR, amplifiant donc encore le phénomène. On estime que les mutations de gain de fonction du gène PI3KCA sont présentes dans 40% des cancers du sein et dans 30% des cancers du colon.
Quelques vidéos didactiques détaillant la voie de signalisation PI3K-Akt-mTOR, par Joe DeMasi, Professeur au Massachusetts College of Pharmacy and Health Sciences :
1. Overview - 2. PIP2 and PIP3 - 3. PI3K regulation - 4. PI3K in cancer - 5. PTEN - 6. Akt regulation - 8. Akt substates (1) - 9. Akt substrates (2)
Les syndromes PROS
C’est là qu’intervient la perspicacité du Docteur Guillaume Canaud de l’hôpital Necker Enfants Malades.
Le spectre de syndromes PROS est un ensemble de syndromes d’hypertrophies atteignant différents tissus, tous liés à des mutations non héréditaires du gène PIK3CA.
Ces syndromes, qui sont multiples, peuvent être plus ou moins invalidants, pouvant aller d’une simple hypertrophie des doigts jusque’à un syndrome complexe appelé CLOVES, pour « Congenital Lipomatous Overgrowth » (excroissances congénitales de tissu adipeux), « Vascular malformations » (malformations vasculaires), « Epidermal nævi » (nævi épidermiques), « Scoliosis/skeletal and spinal syndrome » (scoliose, syndrome squelettique et spinal).
Autrement dit, on peut retrouver l’ensemble ou une partie de malformations caractérisées par une hypercroissance anormale de tissus adipeux, pouvant apparaître sur le tronc et/ou sur les membres, plus rarement au niveau de la tête, des malformations vasculaires graves, conduisant à une fragilité des vaisseaux et à une circulation sanguine fortement altérée, avec souvent des débits cardiaques beaucoup trop importants, des naevus, c’est à dire des taches ou des nodules ressemblant à des grains de beauté, le plus souvent noirs car contenant de la mélanine, et aussi des malformations du squelette, principalement de la colonne vertébrale, conduisant à des scolioses sévères.
Ces syndromes ne doivent pas être confondu avec le syndrome de Protée, bien connu par ceux qui ont vu le film « Elephant Man » de David Lynch, dans lequel John Hurt joue le rôle de John Merrick, personnage ayant vraiment existé au XIXe siècle et atteint de malformations graves aux membres, au tronc, et surtout à la tête. Les symptômes sont très proches de ceux des syndromes PROS, mais si on les distingue, c’est parce que, dans le cas du syndrome de Protée, c’est le gène Akt1, produisant la forme principale de la kinase Akt qui est muté. Mais on comprend bien que cela touche à la même voie de signalisation, et donc à la croissance et à la prolifération cellulaire.
Dans les deux cas, il s’agit de mutations congénitales, c’est à dire qu’elles se produisent in utero, pendant la croissance de l’embryon, mais elles sont post-zygotiques, c’est à dire qu’elles ne sont pas présentes au moment de la fécondation par accouplement des deux gamètes, l’ovule et le spermatozoïde. Il ne s’agit donc pas d’une maladie génétique héréditaire.
Du fait que ces mutations se produisent après la fécondation sur un embryon comportant plusieurs, voire de nombreuses cellules, il est évident que le gène impliqué, considérons ici PIK3CA, ne sera pas muté dans toutes les cellules. On parle ici de mutation « mosaïque », signifiant que le même gène existera sous forme de deux, voir de plusieurs sortes d’allèles différents. On parlera d’un effet mosaïque de x %. Bien entendu, au plus il y a de gènes mutés, au plus le risque d’existence du syndrome PROS est grand. Ce sont les mutations qui produisent des allèles hypermorphes conduisant à des kinases PI3K𝜶 hyperactives qui sont problématiques ici, car elles vont entrainer dans certaines parties du corps, issues du développement cellulaire de cellules affectées de l’embryon, une hyperactivité de la kinase PI3K, donc maintenir PIP3 activée de façon prolongée, donc aussi Akt, et donc une abolition de l’apoptose, une synthèse protéique et d’ADN prolongée, donc un cycle cellulaire qui ne s’interrompt pas, ce qui conduit à une division cellulaire qui ne s’interrompant pas, et donc à une prolifération cellulaire. Ce qui se traduit par les hypercroissances de tissus évoqués plus haut, mais aussi aux malformations des vaisseaux sanguins et aux malformations du squelette.
Les premiers signes peuvent apparaître plus ou moins tard, mais toujours pendant l’enfance et parfois avant l’âge d’un an.
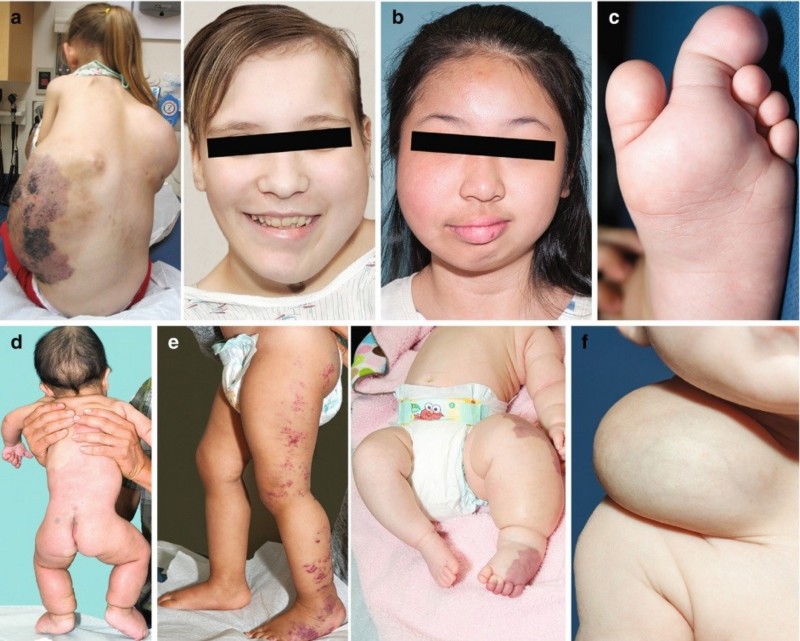
Quelques exemples de syndromes PROS
Excroissances de tissus adipeux, membres hypertrophiés, problèmes vasculaires, problèmes de peau
Le Docteur Canaud a établi un parallèle entre ces syndromes PROS et un grand nombre de cancers dans lesquels ce sont aussi de mutations de gain-de-fonction du gène PIK3CA qui sont impliquées dans la prolifération cellulaire et l’inhibition de l’apoptose, notamment des cancers du sein. Or, l’industrie pharmaceutique a développé des inhibiteurs de la partie catalytique p110𝜶. Et l’un d’entre eux, produit par Novartis, est particulièrement puissant (de faibles concentrations suffisent à inhiber l’enzyme) et sélectif (il inhibe davantage la forme 𝜶 que les autres formes. Il s’agit de l’Alpelisib, aussi connu sous le code BYL719 qui inhibe les formes p110α, p110γ, p110δ, and p110β avec des IC50s of 5 nM, 250 nM, 290 nM and 1200 nM respectivement, montrant une grande affinité et une grande spécificité pour la forme p110α. L’équipe du Dr Canaud a développé un modèle de souris transgénique dans lequel le gène PIK3CA était muté et provoquait des hypercroissances de tissus et d’autres lésions caractéristiques du CLOVES/PROS. Ils ont pu ainsi mettre en évidence l’efficacité du BYL719 dans ce modèle, montrant une réduction des symptômes par rapport à un placebo. La démonstration de l’efficacité sur la souris étant faite, ils ont commencé par traiter deux patients dont les symptômes d’hypercroissances tissulaires, de scoliose et de malformations vasculaires étaient tellement développé, que leurs conditions de vie étaient fortement altérées, et même leur espérance de vie fortement réduites.
Il s’agissait d’un jeune homme de 29 ans et d’une enfant de 9 ans. Ils ont reçu des doses faibles de BYL719. L’homme de 29 ans a reçu la plus petite dose utilisée dans les études cliniques contre le cancer. L’enfant a reçu la plus petite dose disponible, soit le quart de la dose de l’adulte. Dans les deux cas, des améliorations importantes, notamment une réduction des masses, une réduction de la scoliose et une amélioration notoire de l’état des vaisseaux sanguins ont été observés après 6 mois de traitement. Suite à ces résultats encourageants, ils ont reçu l’autorisation de traiter 17 patients, tous à un stade de PROS mettant leur vie en danger, dont six avaient un syndrome de CLOVES, deux avec une mégalencéphalie (croissance anormale du cerveau ou dystrophie faciale) et les autres, des hypertrophies des membres, du dos ou de la face. Aucun autre traitement ne s’était avéré efficace chez aucun d’entre eux, notamment la rapamycin, inhibiteur du complexe mTORC1. Le groupe comprenait 14 enfants recevant 50 mg par jour et 3 adultes recevant 250 mg par jour. Des analyses ont été effectuées après 3 et 6 mois, comprenant des examens par IRM et PET Scan. Après 6 mois, tous les patients montrent une amélioration de leurs symptômes, avec une diminution moyenne des hypertrophies de 16%, une réduction des scolioses et une amélioration de la peau, les navet étant devenus plus minces. Les deux patients qui étaient sous morphine ont pu l’arrêter., et ceux souffrant de mégalencéphalie ont vu une amélioration de leurs fonctions cognitives. Après six mois, aucun patient n’a du être opéré et tous étaient encore en vie. Suite à ces résultats, une étude a été menée avec la collaboration de Novartis, le fabricant de l’alpelisib (BYL719), avec le Dr Canaud comme investigateur principal. Cette étude (EPIK-P1) a observé les résultats obtenus sur 57 patients après 24 semaines de traitement. Une réduction de volume des hypertrophies de plus de 20% a été observé chez 38% d’entre eux. Ceci constituait le but idéal à atteindre au bout de ces 24 semaines. Mais en outre, 74% ont montré une réduction moyenne de 14%, 90% voyaient leurs douleurs diminuer, une réduction de la fatigue était observée chez 76%, une amélioration des malformations vasculaires chez 79%, et une réduction de l’asymétrie des membres chez 69%.
Ces résultats ont été présentés au congrès ESMO (European Society of Médical Oncology) en septembre 2021.
Suite à cet ensemble de ces résultats positifs, et considérant qu’il n’existait aucun autre traitement contre les syndromes du groupe PROS, la FDA a approuvé, le 5 avril 2022, l’utilisation de l’alpelisib (BYL719) pour l’ensemble du spectre des syndromes d’hypercroissances liées au gène PIK3CA (PROS).
La perspicacité du Docteur Guillaume Canaud de l’hôpital Necker-Enfants Malades est ainsi récompensée, et permet une amélioration thérapeutique de ces pathologies rares, mais qui atteint quand même au moins 1000 personnes en France, chiffre très vraisemblablement sous-estimé, et donc le diagnostic demande à être affiné.