Chimie organique
La chimie organique est la chimie des dérivés du carbone. Et pas la chimie des organismes vivants, qui est, elle, la biochimie. Certes les deux se tiennent, puisque les molécules du vivant sont en très grande partie des molécules constituées de façon dominante d'atomes de carbone.
Mais la chime organique touche à beaucoup d'autres domaines que le vivant. D'ailleurs, si la chimie organique étudie les produits naturels animaux et végétaux, beaucoup de molécules organiques sont toutefois des produits de synthèse. Parmi les domaines d'application de la chimie organique, on trouve par exemple:
- Carburants et autres combustibles liquides
- Matières plastiques.
- Peintures et vernis.
- Textiles synthétiques (rayonne, nylon, orlon, tergal, rilsan, etc.).
- Colorants.
- Savons et détergents.
- Insecticides et produits phytosanitaires (fongicides, pesticides)
- Médicaments de synthèse (antibiotiques, antihistaminiques, anti-tumoraux, contraceptifs, etc.).
- Édulcorants (remplaçant le sucre).
- Cosmétiques et parfums.
- Explosifs ...
La plupart des solvants organiques et les produits de base des synthèses de produits organiques proviennent du craquage du pétrole. Le pétrole provenant de la dégradation de végétaux, la terminologie « Chimie organique » vient de là.
Les autres éléments les plus abondants des molécules organiques sont, l'hydrogène d'abord, puis l'oxygène et l'aazote. Soufre et phosphore sont aussi souvent présents, ainsi que les halogènes (chlore, brome, fluor et iode).
Asymétrie
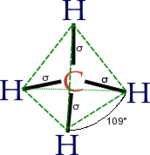
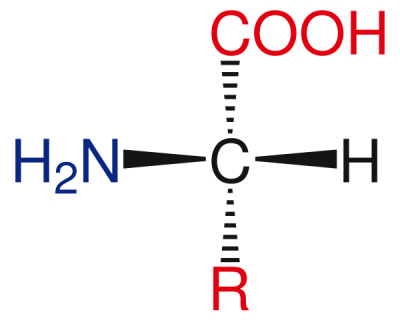
La majorité des atomes de carbone des molécules organiques ont une organisation de leurs liaisons avec les atomes voisins sous forme de tétrahèdre (sauf lorsqu'ils sont liés aux voisins par des doubles ou des triples liaisons, ou dans les cycles aromatiques). Les 4 liaisons du carbone forments des angles de 109°, et les 4 atomes voisins peuvent être reliés par des lignes imaginaires formant un tétrahèdre régulier, c'est à dire une pyramide à base triangulère ayant 4 faces identiques.
Tout atome ou groupe d'atomes remplaçant un des hydrogènes de la molécule de méthane (CH4) représentée ci-dessus, est appelé substituant (parce qu'ils se substituent à un hydrogène. Ils sont souvent représentés schématiquement par des symboles R1, R2, R3 ...).
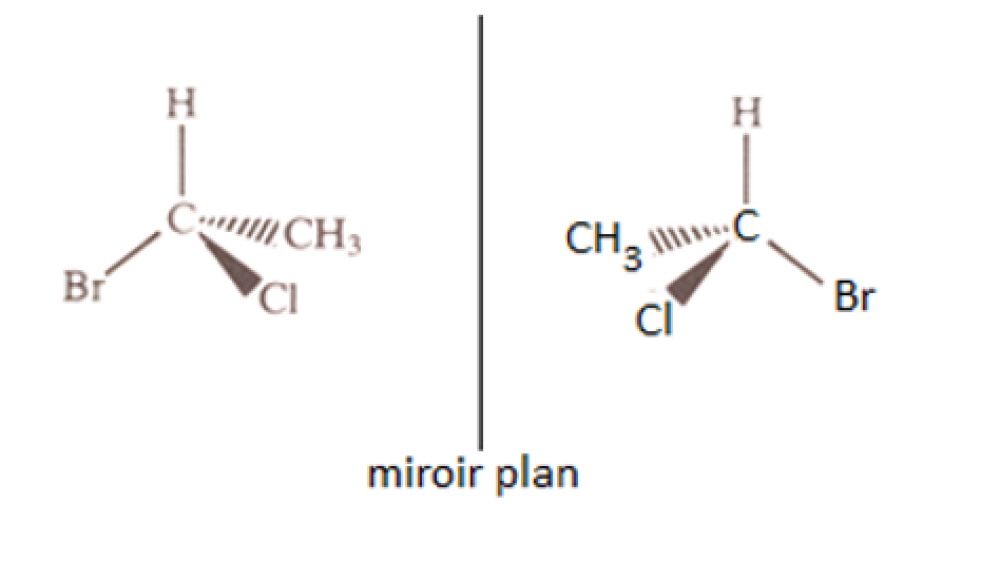
Lorsque les 4 substituants d'un carbone sont tous différents, il n'y a plus de plan de symétrie passant par ce carbone, et celui-ci devient asymétrique, c'est à dire que son image dans un miroir ne lui est pas superposable. De façon similaire à la main gauche et à la main droite, qui ne sont pas superposable (les mettre l'une contre l'autre n'est pas une superposition, c'est une opposition. Un superposition requiert que les paumes soient tournées du même côté. Dans ce cas, une main à le pouce à gauche et l'autre à droite). Les Anglo-Saxons, pour décrire cette propriété asymétrique des molécules, parlent d'ailleurs de façon imagée, de « handedness » dans leurs articles de vulgarisation. Le terme correct pour parler de l'asymétrie des molécules est « CHIRALITÉ » (du grec χείρ : la main).
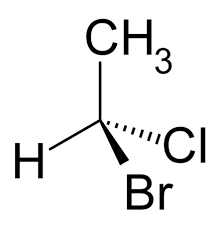
Dans l'exemple ci-contre, le 1-bromo-1-chloro-ethane possède un carbone asymétrique. Et on voit très bien qu'il est impossible de faire passer un plan de symétrie par le carbone central. Cette molécule et son image dans un miroir, représentées ci-dessous, ne sont pas superposables.
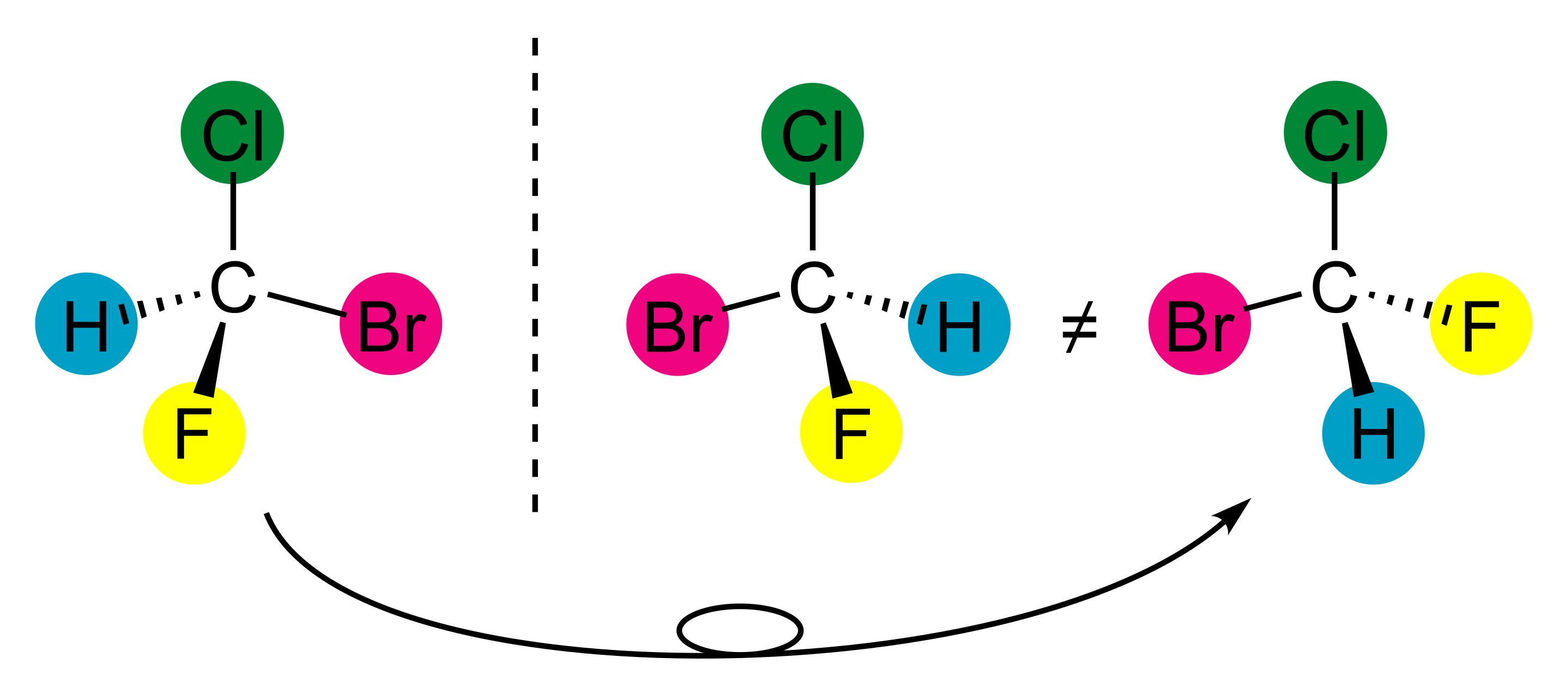
Dans l'exemple quelque peu différent, ci-dessous, du bromo-chloro-fluoro-méthane, on voit bien que toute tentative de pivotement de la molécule de gauche, visant à faire au moins se superposer les atomes de brome et de chlore, ne permet pas de superposer les deux autres atomes de fluor et d'hydrogène. Ceci permet aussi d'observer que si dans une molécule asymétrique, je permute deux des substituants du carbone constituant le centre de l'asymétrie, j'obtiens l'autre molécule asymétique, image dans un miroir de la première. Ces deux molécules sont donc bien différentes l'une de l'autre, mais étant constituées des mêmes atomes, on peut affirmer que ce sont deux isomères. Dans ce cas particulier de molécules asymétriques, images l'une de l'autre dans un miroir, on définit ces deux isomères comme étant des énantiomères.
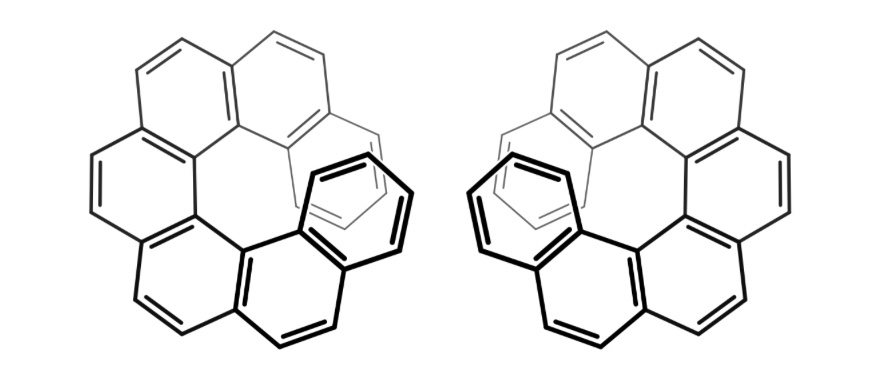
Il s'agit ici de l'asymétrie la plus courante dans les molécules organiques, due à un carbone lié à 4 substituants différents. On parle de centre asymétrique ou encore d'asymétrie centrale. Une même molécule peut posséder plusieurs centres asymétriques, comme c'est fréquemment le cas dans les molécules des êtres vivants, qui en posssèdent parfois un très grand nombre. Toutefois, l'asymétrie centrale n'est pas le seul mode d'asymétrie rencontrée dans les molécules organiques. La condition nécessaire et suffisante pour qu'une molécule soit asymétrique est qu'elle n'ait pas de plan de symétrie. On a souvent entendu parler de la structure de la molécule d'ADN, découverte en 1953, et qui valu le prix Nobel de Médecine à Watson, Crick et Wilkins en 1962 (Rosalind Franklin étant décédée en 1958). Et on sait que l'ADN est formé de deux hélices entrelacées, l'une correspondant à un pas de vis droit, l'autre à un pas de vis gauche. Une structure hélicoïdale, indépendamment du fait qu'elle comporterait des carbones asymétriques ou pas, ne comporte pas de plan de symétrie, et est donc asymétrique. Son image dans un miroir, c'est à dire son énantiomère, qui ne lui est pas superposable, est l'hélice ayant le pas inverse (Attention ! Les hélices droite et gauche de l'ADN ne sont pas images dans un miroir l'une de l'autre, car leurs compositions atomiques sont différentes). Dans ce cas, la molécule pouvant tourner autour d'un axe, on parle d'asymétrie axiale, et non centrale. Les hélicènes sont un parfait exemple de molécules asymétrique (donc chirales) ne possédant aucun centre d'asymétrie, mais un axe d'asymétrie. Les hélicènes sont formés par la condensation de cycles benzéniques (le benzène est une molécule aromatique, c'est à dire formée des molécules formant un ou plusieurs cycles, constitués uniquement d'atomes formant des doubles liaisons. Le benzène est la plus simple d'entre elles, étant constitué d'un seul cycle de 6 carbones). Les cycles sont condensés les uns aux autres de façon à ce que la molécule résultante ne soit pas rectiligne. Elle finit donc par former un cercle. Mais, alors que la condensation de cycles benzéniques forme une molécule plane, une fois le cercle atteint, l'encombrement fait qu'une torsion est nécessaire, le cycle additionnel passant en dessous ou au dessus du premier cycle, pour former une hélice gauche ou droite. On désigne les hélicènes par leur nombre de cycles benzéniques. Voici donc les deux énantiomères gauche et droit du heptahélicène.
Nomenclature
Il existe différentes façons de distinguer les deux énantiomères d'une molécule, ce qui induit une certaine confusion, qui a obligé les chimistes organiciens de définir une règle non-ambigüe. Nous ne parlerons ici que de l'asymétrie centrale, nous limitant pour les hélices à parler d'hélice droite ou d'hélice gauche, selon que leur pas tourne dans le centre des aiguilles d'une montre ou l'inverse.
Le premier type de nomenclature distingue les énantiomères par les lettres minuscules l et d. À ne surtout pas confondre avec les majuscules L et D dont nous allons parler plus loin.
Lévogyre et dextrogyre
Les minuscules l et d signifient lévogyre et dextrogyre. C'est à dire qui tourne à gauche et qui tourne à droite. En effet, lorsqu'un énantiomère est séparé de l'autre, si on le met en solution dans une cellule en verre, et si on fait passer au travers de cette cellule une lumière polarisée, c'est à dire une lumière dont toutes les ondes lumineuses se trouvent dans un même plan, on observe que le plan de polarisation de la lumière à tourné d'un certain angle en traversant la solution. C'est une particularité propre aux molécules asymétriques. Si le plan de la lumière polarisée tourne vers la gauche (sens inverse des aiguilles d'une montre), on dira que l'énantiomère est lévogyre. Si on recommence la mesure avec l'autre énantiomère, et pour peu que sa concentration en solution soit la même, on constatera le même angle de rotation du plan de la lumière, mais en sens opposé, soit vers la droite. Cet énantiomère est dextrogyre. L'angle de rotation du plan de la lumière polarisée est appelé pouvoir rotatoire. Afin de standardiser la mesure, on tient compte de la concentration utilisée et de la largeur de la cellule contenant la solution, pour obtenir un pouvoir rotatoire spécifique, qui est un paramètre physique propre à un énantiomère d'un dérivé chiral, au même titre qu'une température de fusion par exemple.
Dans le cas du 1-bromo-1-chloro-ethane montré plus haut, l'un sera le l-1-bromo-1-chloro-ethane et l'autre le d-1-bromo-1-chloro-ethane. Mais si à chaque fois qu'on dispose d'un énatiomère pur de l-1-bromo-1-chloro-ethane, le pouvoir rotatoire (son signe et son amplitude) doit être le même, il est impossible de prédire, à partir de la structure d'un composé chiral, quel énantiomère sera lévogyre, et lequel sera dextrogyre. C'est tout à fait aléatoire, et le signe et l'amplitude peut varier de composé à composé, même de structure proche. L'utilité de ce paramètre réside surtout à identifier, pour un composé chiral donné, de quel énantiomère il s'agit, grâce au signe du pouvoir rotatoire, et son degré de puraté, grâce à l'angle de rotation de la lumière par rapport à celui attendu pour le produit pur.
Droit ou gauche
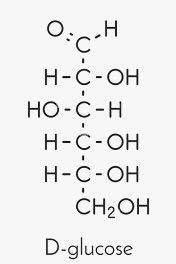
Pour permettre une relation plus directe entre la stéréochimie (la chimie tenant compte de l'asymétrie du ou des carbones d'une molécule), on a inventé un autre système de nomenclature des énantiomères, utilisée principalement en biochimie pour décrire les molécules présentes dans les êtres vivants, lesquelles sont pour leur toute grande majorité, présentes sous la forme d'un seul des énantiomères. Pour ce faire, on a pris comme référence la molécule de glucose naturelle, qui est dextrogyre. Donc, le d-glucose. On l'appelle aussi parfois le dextrose, indiquant ainsi le signe de son pouvoir rotatoire. Et par simple définition, on a stipulé que le glucose dextrogyre (d-glucose) serait le D-glucose. Le voici représenté sous sa forme ouverte, dans un mode de représentation dite projection de Fischer :
Dans ce type de projection, le groupement aldéhyde (CH=O) en début de chaîne est censé pointer vers le bas, par rapport au premier carbone asymétrique, auquel il est relié. Donc, l'hydrogène, et le groupement hydroxyle (aussi appelé groupement alcool, OH) pointent vers le haut, et la liaison vers le carbone suivant pointe elle vers le bas.
La majorité des sucres comportent 5 ou 6 carbones. Ce sont des pentoses ou des hexoses. Le glucose est un hexose. Ils se caractérisent par la présence d'une fonction aldéhyde en début de chaine (CH=O) et d'un groupement CH2OH en fin de chaîne. Tous les sucres, que ce soit des pentoses ou des hexoses, qui possèreont la même orientation spatiale (la même stéréochimie) sur le carbone adjacent à l'aldéhyde sont définis comme étant des sucres de stéréochimie D, ce qui est le cas pour la toute grande majorité des sucres présents dans les organismes vivants.
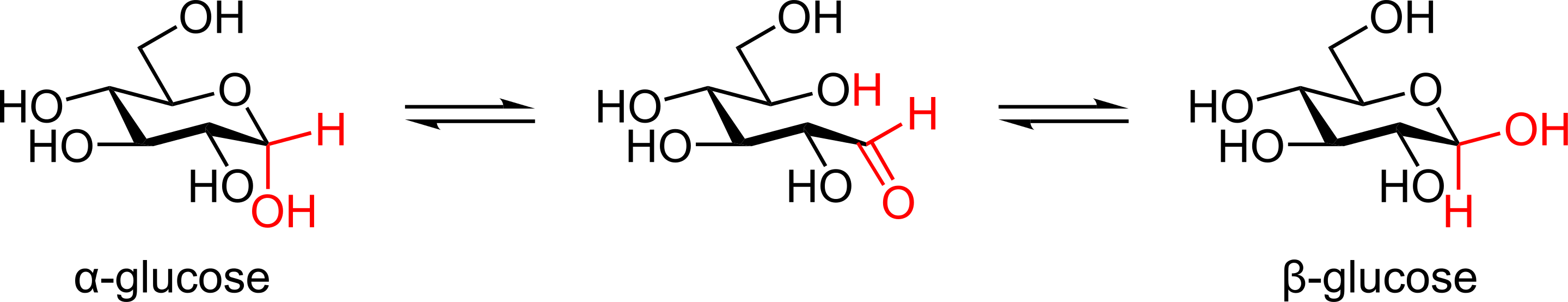
Il est important de noter, en ce qui concerne les sucres, qu'ils sont en équilibre avec leurs formes cycliques. Un aldéhyde (-CH=O) peut en effet réagir avec un alcool (-OH) pour former une fonction aldol (R1-O-CHR2-OH). Dans le cas du D-glucose, l'alcool situé sur le 4ème carbone après celui de l'aldéhyde (juste avant le groupement -CH2OH) permet de former un cycle à 6 atomes. Selon la face de l'aldéhyde attaquée par le groupement-OH, deux configuration du glucose cyclique sont possible : la forme alpha (le -OH de l'aldol est vers le bas) et la forme beta (le groupement -OH de l'aldol est vers le haut. Les trois formes sont en équilibre, ce qui signifie qu'elles peuvent s'interchanger l'une en l'autre.
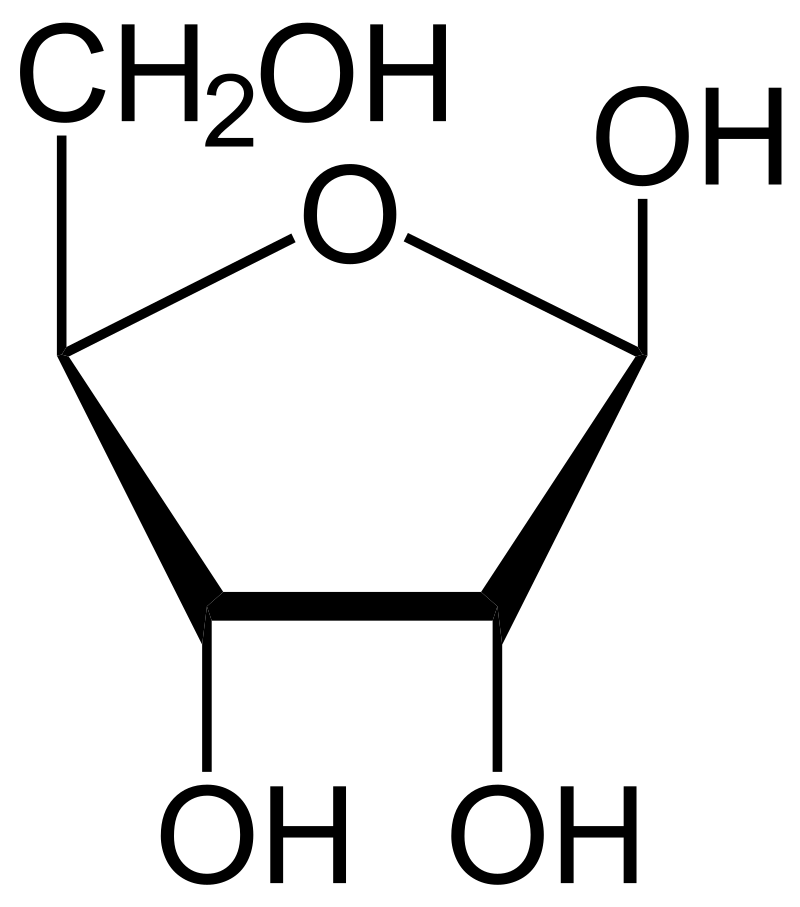
De la même façon, un pentose est en équilibre avec sa forme cyclique, donnant lieu à un cycle à 5 atomes, comme dans le D-ribose, représenté ici sous sa configuration beta (-OH de l'aldol vers le haut) :
À partir de cette description géométrique des isomères du glucose et des sucres en général, et donc aussi des polysacharides, lesquels sont en grande majorité de configuration D dans les organismes vivants, cette description géométrique de la configuration des énantiomères a été étendue à d'autres types de molécules, par analogie. Ainsi pour les 20 acides aminés naturels :
on observe qu'en respectant la même projection de Fischer, dans laquelle 1. la plus longue chaîne est placée verticalement, 2. le groupement le plus oxydé est placé en haut, 3. la chaîne est tournée de telle manière que ce groupement le plus oxydé pointe vers l'arrière par rapport à l'observateur, le groupement aminé (-NH2), à considérer ici en lieu et place du groupement alcool (-OH) des sucres, est située à gauche. Les acides aminés naturels sont donc eux de configuration L.
Ce type de nomenclature D ou L permet de définir la stéréochimie d'un très grand nombre de produits naturels : sucres, polysacharides, acides aminés, peptides, protéines et tout les composés naturels plus complexes en comprenant, mais il est aisé de comprendre que cette nomenclature ne peut en aucun cas être universelle, non seulement pour les produits organiques de synthèse n'appartenant pas au monde du vivant, mais aussi pour des molécules présentes dans les organismes vivants. En voici deux exemples :
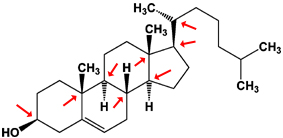
Cholestérol
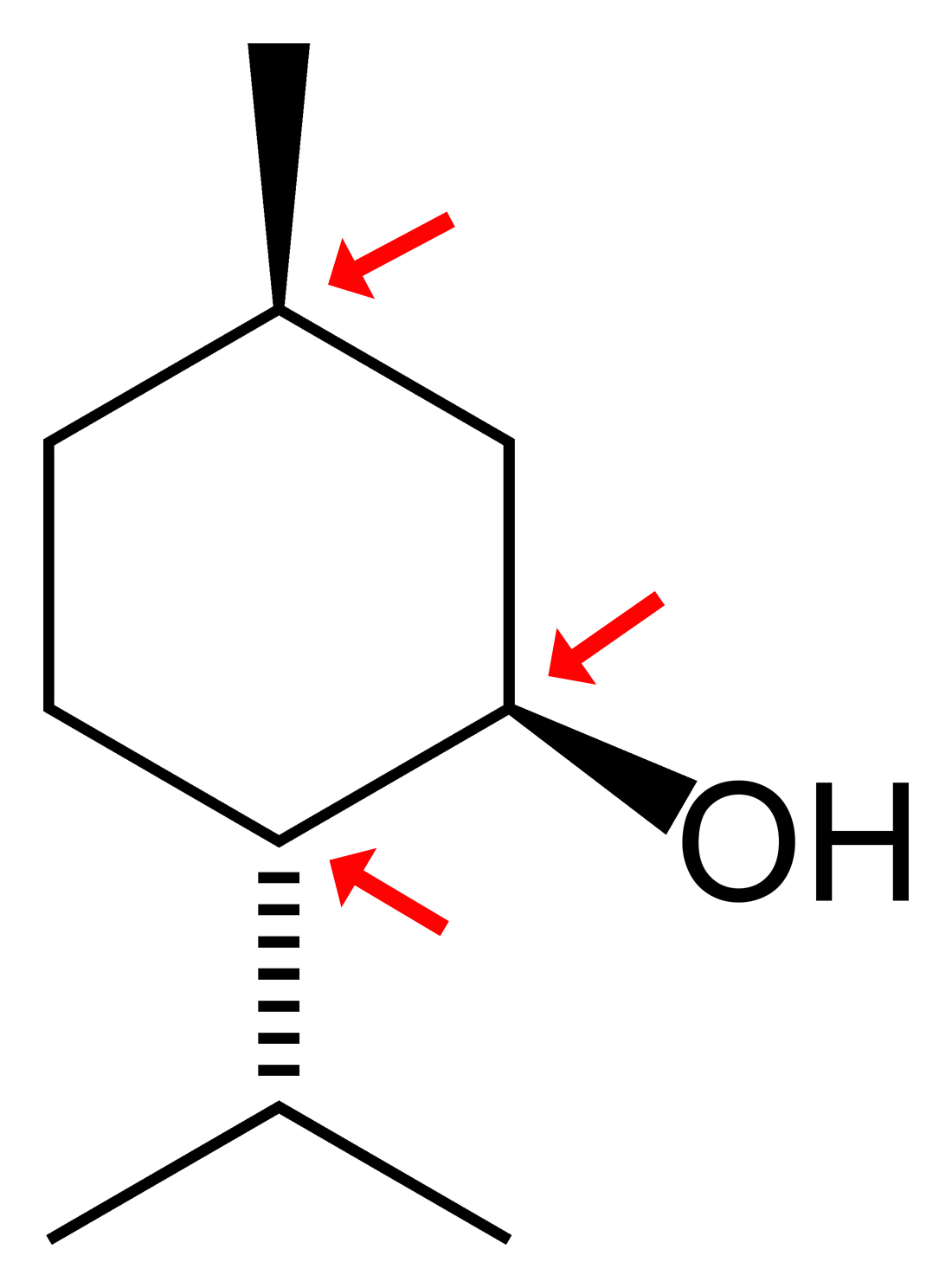
d-Menthol
Le cholestérol comporte pas moins de 8 carbones asymétriques, et le d-menthol en comporte 3. La nomenclature D/L ne peut pas être utilisée ici.
Nomenclature universelle de Cahn-Ingold-Prelog R (rectus) et S (sinister)
Les 4 substituants d'un carbone asymétrique sont classés par ordre de priorité, selon un certain nombre de règles:
- Celui ayant le nombre atomique Z (c'est à dire le plus grand nombre d'électrons ou de protons) a la priorité la plus élevée. L'oxygène (Z=8) sera prioritaire sur l'azote (Z=7), lui-même prioritaire sur le carbone (Z=6) et sur l'hydrogène (Z=1).
- Si plusieurs carbones sont liés au carbone asymétrique, celui portant un atome de nombre Z le plus élevé sera prioritaire. le substituant -CH2-OH est prioritaire sur -CH3 et même sur -CH2-CH3.
- Si on ne peut pas distinguer ainsi ce premier carbone, on passe au suivant et ainsi de suite.
- Dans le cas où la chaîne de plusieurs carbones se ramifie en 2 ou 3 chaînes, on parcourt la chaîne la plus longue, et on continue le même exercice.
- Si aucun atome de Z plus élevé que le carbone n'est observé sur les différents substituants du carbone asymétrique, le substituant possédant la chaîne d'atomes de carbone la plus longue est prioritaire.
- En cas d'égalité, le substituant ayant le taux de ramification le plus élevé est prioritaire
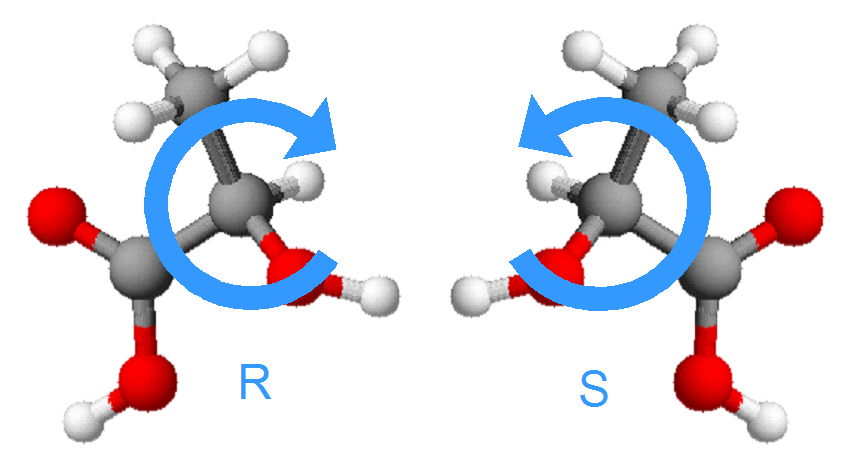
Ayant établi un ordre de priorité a>b>c>d, l'oeil de l'observateur se place de façon à ce que le substituant de plus faible priorité (d) soit rejeté vers l'arrière, tandis que les 3 autres substituants pointent vers lui, à la manière d'un parapluie ouvert. On regarde alors dans quel sens il faut tourner pour passer de a vers b puis vers c. Si ce sens est horlogique, la configuration de l'énantiomère est R. S'il est antihorlogique, la configuration est S
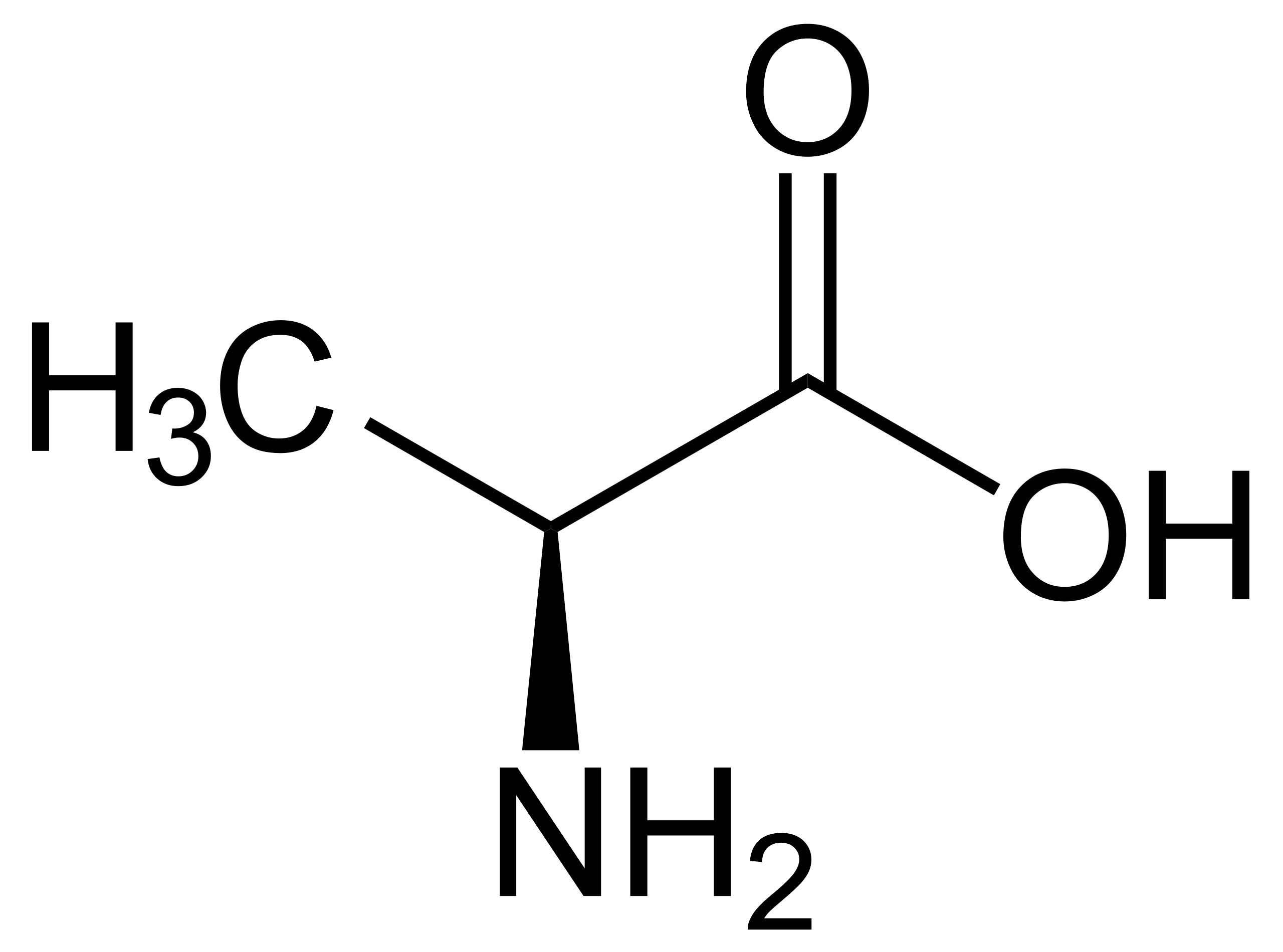
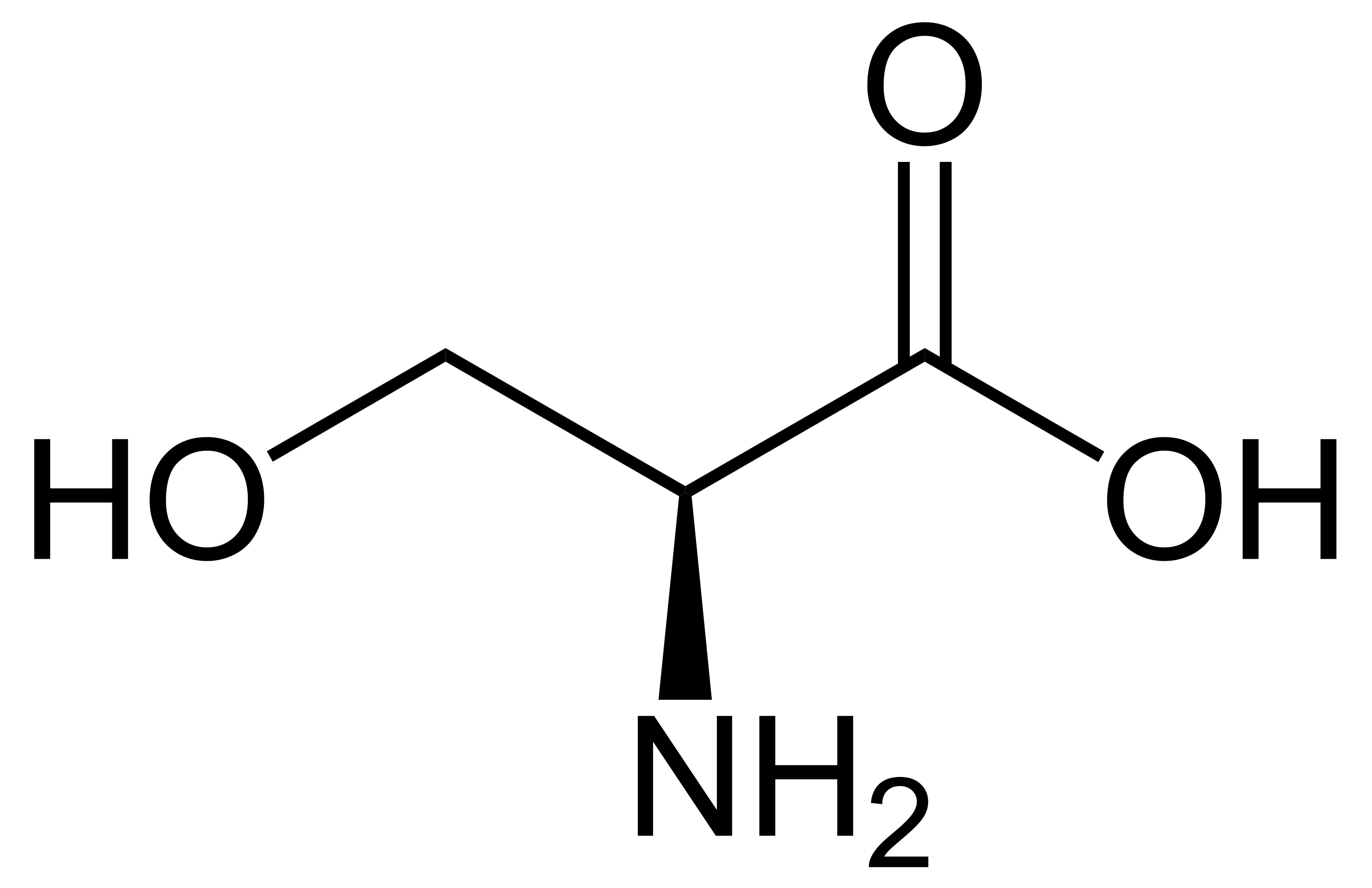
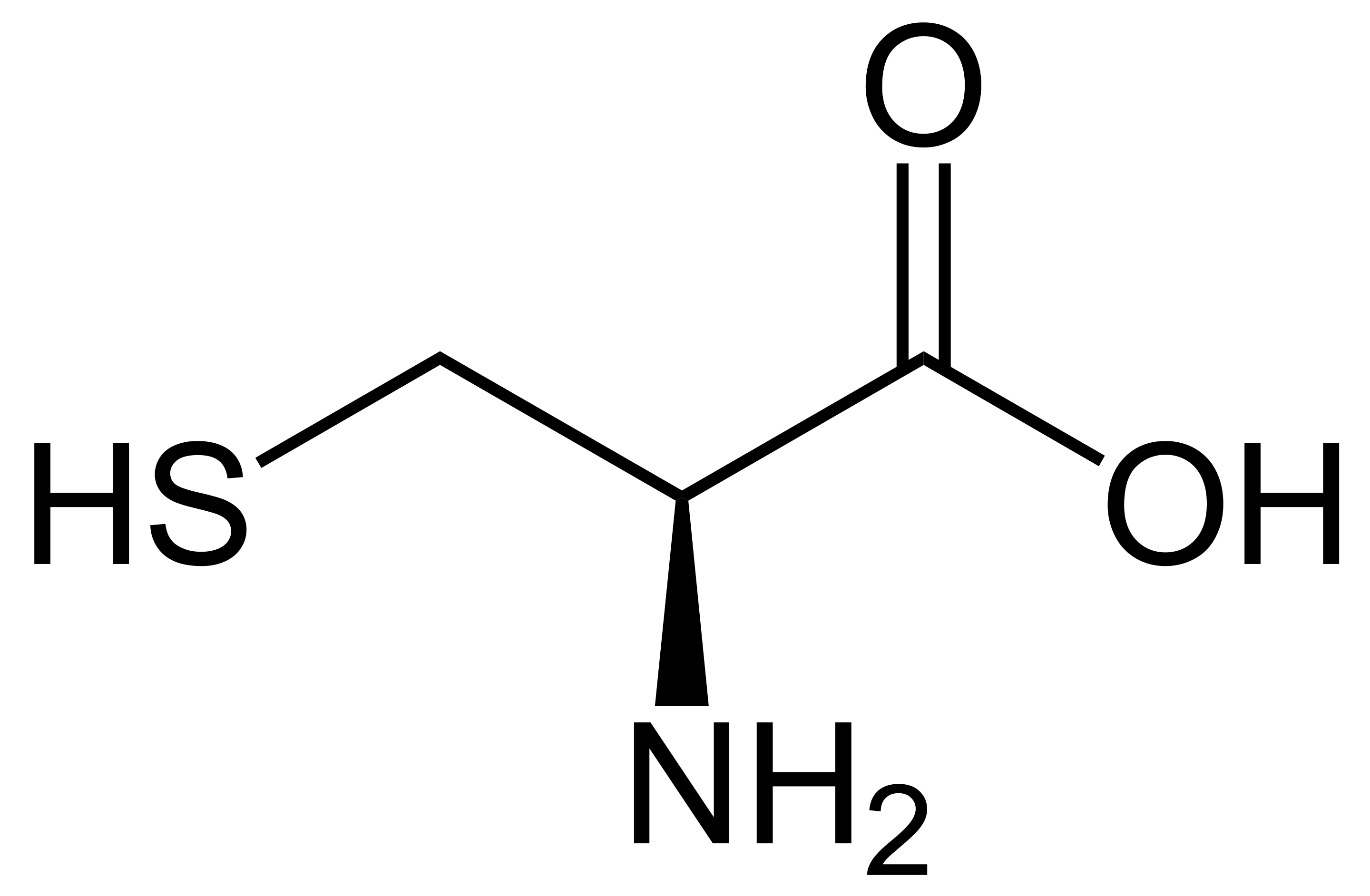
Parmi les acides aminés, seule la glycine H2N-CH2-COOH ne possède pas de carbone asymétrique car elle posède deux substituants identiques (deux hydrogènes) sur le carbone. Presque tous les acides aminés naturels (de configuration L) sont de configuration S, selon la règle de Cahn-Ingold-Prelog, comme par exemple la L-alanine ou la L-sérine, car le substituant de plus haute priorité est -NH2 suivi du carbone portant deux oxygènes. Il existe une seule exception à cela, c'est le cas de la L-cystéine, car des deux carbones liés au carbone asymétrique, c'est celui portant l'atome de soufre qui a la priorité car le soufre a un Z de 16, contre 8 pour l'oxygène.
Les réactions chimiques ne créent pas d'asymétrie : le mélange racémique
Les produits de départ des réactions chimiques sont normalement symétriques. Comment naissent les centres d'asymétrie ?
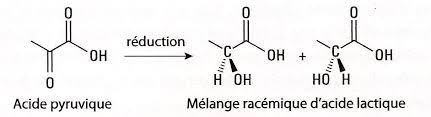
Prenons l'exemple simple de la réduction par du dihydrogène (H2) de l'acide pyruvique en acide lactique :
La molécule d'H2 attaque le groupement cétone (C=O) de l'acide pyruvique, pour lui ajouter deux hydrogènes, donnant lieu à un carbone asymétrique, puisque les 4 substituants de l'acide lactique formé sont différents (-COOH, -OH, -CH3 et-H). Mais la probabilité que la molécule de dihydrogène, H2, attaque la cétone (C=O) par l'avant ou par l'arrière de celle-ci est exactement la même. On obtient donc un mélange 50/50 d'acide S-lactique (à gauche) et d'acide R-lactique (à droite). Comme ils ont chacun le même pouvoir rotatoire, mais de signe opposé, le mélange n'est donc pas « optiquement actif », sont pouvoir rotatoire est nul, et on n'a donc pas créé d'asymétrie.
Ce mélange 50/50 des énantiomères R et S est appelé mélange racémique. Son pouvoir rotatoire est nul.
Pour pouvoir obtenir un seul des énantiomères, il n'y a que deux possibilité:
- soit on réalise une réaction sur un produit qui est déjà un énantiomère pur d'un produit chiral
- soit on sépare le mélange racémique en ses deux énantiomères. Mais cette séparartion ne peut se faire que si l'instrument qui effectue la séparation comporte lui-même un élément asymétrique
On voit donc qu'il est impossible de créer de l'asymétrie, si au préalable, il n'existe pas déjà un élément lui-même asymétrique, que ce soit un réactif ou un instrument permettant la séparation d'un mélange racémique
Nous terminerons donc cet article par une question que nous laiserons en suspend :
Comment est née l'asymétrie des molécules présentes dans les êtres vivants, que ce soit les sucres, les protéines, l'ADN, l'ARN, etc ... qui n'y sont présent que sous la forme d'un seul des deux isomères optiques, et qui est une condition nécessaire aux mécanismes de la vie, pour que lors des interactions entre molécules du vivant, la bonne clé rencontre la bonne serrure ?