NATURE NEWS FEATURE - 25 JANVIER 2023
La course pour suralimenter les lymphocytes T anticancéreux
Avec une multitude d'outils pour PERSONNALISER les cellules immunitaires, les chercheurs élargissent le répertoire des thérapies CAR-T
par Heidi Ledford
Nature podcast par Nick Petrić Howe & Benjamin Thompson

Illustration par Fabio Buonocore
Crystal Mackall se souvient de son scepticisme la première fois qu'elle a entendu parler d'un moyen de concevoir des lymphocytes T pour reconnaître et tuer le cancer. Assise dans le public lors d'une réunion en 1996 en Allemagne, l'oncologue pédiatrique s'est tournée vers la personne à côté d'elle et a dit: « Pas question. C'est trop fou. »
Aujourd'hui, les choses sont différentes. « J'ai été impressionnée », déclare Mackall, qui travaille maintenant à l'Université de Stanford en Californie pour développer de telles cellules pour traiter les tumeurs cérébrales. La Food and Drug Administration des États-Unis a approuvé les premières cellules T modifiées, appelées cellules T-récepteurs antigéniques chimériques ( Chimeric Antigenic Receptors, CAR ) pour traiter une forme de leucémie en 2017. Les traitements ont changé la donne pour plusieurs cancers. Cinq produits similaires ont été approuvés et plus de 20 000 personnes les ont reçus. Un domaine autrefois dirigé par une poignée de chercheurs acharnés compte désormais des centaines de laboratoires dans les universités et l'industrie. Plus de 500 essais cliniques sont en cours et d'autres approches se préparent à passer du laboratoire à la clinique alors que les chercheurs se précipitent pour affiner la conception des cellules T et étendre leurs capacités. « Ce domaine va aller bien au-delà du cancer dans les années à venir » prédit Crystal Mackall.
Les progrès de l'édition du génome grâce à des processus tels que CRISPR et la capacité de rediriger les cellules grâce à la biologie synthétique ont conduit à des approches de plus en plus élaborées pour modifier et doper les cellules T à des fins thérapeutiques. Ces techniques fournissent des outils pour contrer certaines des limites des thérapies CAR-T actuelles, qui sont coûteuses à fabriquer, peuvent avoir des effets secondaires dangereux et n'ont jusqu'à présent réussi que contre les cancers du sang. « Ces techniques ont élargi ce que nous sommes capables de faire avec les stratégies CAR », déclare Avery Posey, chercheur en immunologie du cancer à l'Université de Pennsylvanie à Philadelphie. « Cela va vraiment faire avancer ce type de technologie. »
Même ainsi, le défi de fabriquer un tel « médicament vivant » à partir des cellules d'une personne va au-delà de ces conceptions compliquées. Des problèmes de toxicité et de fabrication restent à résoudre pour bon nombre des candidats les plus récents. « Il y a énormément de choses qui sont très particulières, et je pense que c'est formidable », déclare l'immunologiste Michel Sadelain du Memorial Sloan Kettering Cancer Center à New York. « Mais les choses complexes ne sont pas toujours être transférées telles que décrites dans un cadre clinique. »
Réactivé et prêt à démarrer
Les thérapies CAR-T capitalisent sur les activités des cellules T, les chasseurs naturels du système immunitaire qui rôdent dans le corps à la recherche de choses qui n'en font pas partie. Les cellules étrangères, ou celles infectées par un virus, expriment des protéines inhabituelles qui servent de balise aux cellules T, dont certaines libèrent un mélange toxique de molécules pour détruire les cellules anormales. Cette fonction de recherche et de destruction peut également cibler les cellules cancéreuses pour les éliminer, mais les tumeurs ont souvent des moyens de désarmer le système immunitaire, par exemple en masquant des protéines anormales ou en bloquant le fonctionnement des lymphocytes T.
Les cellules CAR-T transportent des protéines synthétiques - les récepteurs antigéniques chimériques - qui traversent la membrane cellulaire. À l'extérieur se trouve une structure qui fonctionne comme un anticorps, se liant à des molécules spécifiques à la surface de certaines cellules cancéreuses. Une fois que la liaison s'est produite, la partie de la protéine à l'intérieur de la cellule stimule l'activité des cellules T, en les mettant sous tension. Le résultat est une minuscule machine à combattre le cancer.
Les thérapies CAR-T approuvées ciblent l'une des deux protéines présentes sur les cellules immunitaires appelées cellules B et sont utilisées pour traiter certaines formes de leucémie et de lymphome qui impliquent la prolifération incontrôlée de ces cellules. Les protéines - CD19 et BCMA - ne sont pas uniques au cancer, ce qui signifie que les thérapies tuent les cellules B sans discrimination. Cependant, les gens peuvent vivre sans ces cellules.
Cellules T (bleues) du système immunitaire attaquant les cellules cancéreuses de la prostate (roses).
Crédit : Steve Gschmeissner/SPL
Il reste encore beaucoup à faire pour améliorer les thérapies CAR-T. Bien que les effets puissent être durables – parfois même curatifs – le cancer finit par réapparaître chez la plupart des personnes qui ont été traitées. Les tumeurs solides, telles que celles présentes dans les cancers du poumon ou du pancréas, n'ont jusqu'à présent pas répondu de manière convaincante aux cellules CAR-T. La thérapie comporte des risques et peut, dans de rares cas, être mortelle. Et elle doit être faite sur mesure pour chaque patient, en utilisant ses propres lymphocytes T comme point de départ, ce qui entraîne un processus de fabrication relativement lent et coûteux.
Pour l'instant, il n'existe pas de solution simple à aucun de ces problèmes. « Nous avons clairement un long chemin à parcourir », déclare Mackall. « Mais nous voyons maintenant des signaux prometteurs. »
Des progrès sont réalisés contre les tumeurs solides. Celles-ci contiennent souvent une mosaïque hétérogène de cellules qui ont différentes combinaisons de mutations. Cela signifie qu'une thérapie CAR-T dirigée contre une protéine mutée particulière pourrait ne fonctionner que pour un seul sous-ensemble de cellules. La masse serrée d'une tumeur solide peut également être difficile à pénétrer pour les cellules T, et les chercheurs ont eu du mal à trouver des cibles appropriées qui ne causeront pas de ravages dans les tissus sains.
Malgré cela, certains essais cliniques ont montré des lueurs d'efficacité. Mackall et ses collègues ont conçu des cellules CAR-T pour cibler une molécule appelée GD2, qui est exprimée à des niveaux élevés par certains cancers du cerveau et de la moelle épinière appelés gliomes. L'équipe a administré une dose intraveineuse de thérapie CAR-T aux personnes atteintes de gliomes, puis a administré plusieurs doses plus faibles directement dans le cerveau. Elle et ses collègues ont rapporté l'année dernière que trois des quatre personnes traitées de cette manière ont répondu positivement. « Ces cellules montent directement dans le cerveau », explique Mackall. « Et le corps ne les rejette pas là-haut - il joue dans cet espace immunitaire privilégié. »
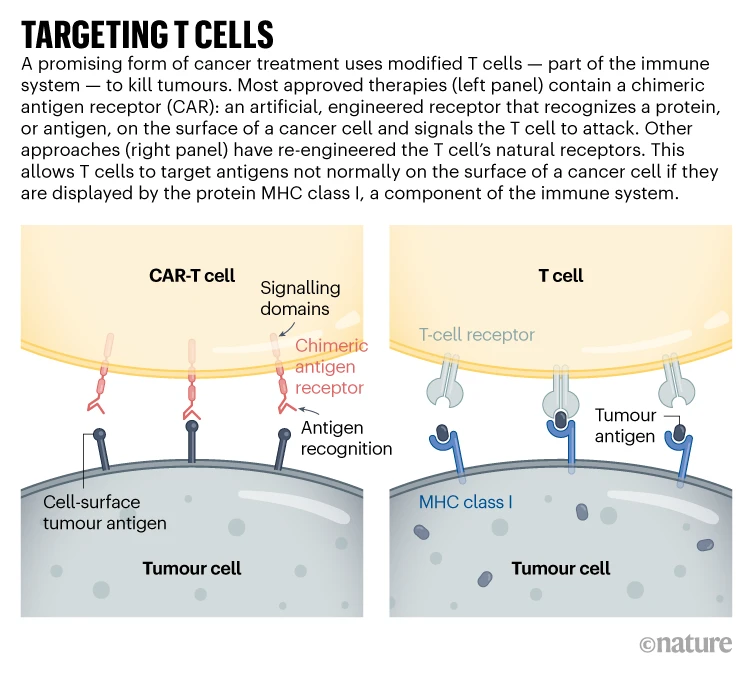
Le ciblage des tumeurs solides pourrait nécessiter des thérapies par lymphocytes T qui reconnaissent plus d'une protéine mutée ou qui peuvent cibler les cellules cancéreuses exprimant des niveaux plus élevés d'une protéine donnée que les cellules normales. Un essai clinique qui a rapporté des résultats en novembre 2022 a poussé cela à l'extrême : plutôt que d'utiliser des CAR, l'équipe a utilisé CRISPR pour concevoir des récepteurs naturels des lymphocytes T ( voir « Targeting T-cells, ci-dessous » ) afin de reconnaître les protéines mutées trouvées dans la tumeur de chaque participant. Les individus ont reçu un mélange de cellules ciblant différentes protéines, dans l'espoir que les tumeurs solides seraient moins susceptibles de développer une résistance à une thérapie à cibles multiples. Les tumeurs ont cessé de croître chez 5 des 16 participants 28 jours après le traitement. Les chercheurs espèrent modifier le protocole, notamment en administrant des doses plus élevées, pour en augmenter l’efficacité.
La capacité de suivre et d'affiner l'activité des lymphocytes T s'améliore également, explique l'immunologiste Carl June de l'Université de Pennsylvanie. Grâce à des analyses unicellulaires avancées, les chercheurs peuvent suivre le sort des cellules modifiées et des tumeurs qu'elles sont destinées à tuer. Ils peuvent déterminer quelles cellules T sont devenues «épuisées» - un état dysfonctionnel qui peut provenir d'une stimulation prolongée - et quelles cellules tumorales deviennent résistantes au traitement. Ils peuvent également voir si l'environnement entourant une tumeur traitée par CAR-T est devenu criblé de cellules immunosuppressives (telles que les macrophages ou les cellules T régulatrices). Surmonter cette suppression immunitaire locale sera la clé pour exploiter les cellules T pour combattre les tumeurs solides, déclare Yangbing Zhao, directeur scientifique chez UTC Therapeutics, une société de biotechnologie basée à Singapour qui développe des thérapies CAR-T. « Peu importe le nombre de cibles que vous ciblez, si la tumeur échappe à la réponse immunitaire, cela ne fonctionnera pas », dit-il.
June et ses collègues ont utilisé une approche unicellulaire pour étudier la résistance aux thérapies CAR-T qui ciblent le CD19 et ont découvert que les CAR-T qui étaient moins capables d'activer certaines cellules T auxiliaires étaient associés à l'émergence de la résistance. Ils ont également utilisé des techniques unicellulaires pour en savoir plus sur les raisons pour lesquelles les cellules CAR-T dirigées contre une protéine appelée mésothéline, présente dans les cellules cancéreuses du pancréas, échouent souvent. La réduction de l'activité de deux gènes dans les cellules CAR-T pourrait renforcer la thérapie. « Nous allons pouvoir comprendre ces mécanismes de résistance », déclare June. « Et puis avec tous ces outils comme CRISPR, nous allons pouvoir essayer de contourner le problème."
En plus de l'édition des lymphocytes T, CRISPR a été utilisé pour trouver d'autres moyens de les modifier. L'immunologue Alexander Marson des instituts Gladstone de San Francisco, en Californie, et ses collègues ont utilisé CRISPR pour activer ou supprimer des milliers de gènes dans les cellules T, puis ont examiné l'effet des changements sur la production de protéines cruciales de régulation immunitaire appelées cytokines. Dans un autre dépistage utilisant CRISPR, l'équipe a découvert que la réduction de l'activité d'une protéine appelée RASA2 augmentait la capacité des cellules CAR-T à tuer leurs cibles. « Nous tirons des leçons des gènes que nous pouvons activer et désactiver pour régler les lymphocytes T afin qu'ils se comportent comme nous le souhaitons », déclare Marson.
Les biologistes synthétiques ont également jeté leur dévolu sur les lymphocytes T et conçoivent des circuits cellulaires sophistiqués qui pourraient permettre un meilleur contrôle de l'expression des CAR et d'autres protéines susceptibles d'augmenter l'activité des lymphocytes T. En décembre de l'année dernière, le biologiste synthétique Wendell Lim de l'Université de Californie à San Francisco et ses collègues ont rapporté qu'ils avaient conçu des cellules T pour exprimer à la fois une CAR et IL-2, une protéine immunorégulatrice. L'IL-2 peut améliorer la pénétration des lymphocytes T dans les tumeurs solides et surmonter les signaux immunosuppresseurs que les tumeurs libèrent, mais elle peut être toxique lorsqu'elle est administrée par voie systémique. Laisser les cellules T produire de l'IL-2 permet l'administration locale de la protéine, qui pourrait contourner sa toxicité pour d'autres tissus.
D'autres circuits synthétiques ont été conçus pour permettre une régulation précise de l'expression du CAR, en le plaçant sous le contrôle d'éléments génétiques qui activent les gènes nécessaires en réponse à un médicament. Jusqu'à présent, cependant, la plupart de ces concepts complexes n'ont pas encore fait l'objet d'études de toxicité et de standardisation requises pour une utilisation chez l'homme, explique Sadelain.
Les chercheurs tirent tellement de leçons de ces travaux que la grande grande question est maintenant de déterminer quelles cellules T modifiées utiliser pour les études chez l'homme, déclare l'oncologue Marcela Maus du Massachusetts General Hospital de Boston. « Nous pouvons inventer et innover tellement en laboratoire, mais il y a un entonnoir à passer pour traduire cela en essais cliniques », dit-elle. « Il y a tellement de choses que nous pouvons faire. Nous devons déterminer quelles sont les meilleures choses à peaufiner et à tester lors des essais.
Entreprise coûteuse
La fabrication de cellules CAR-T est déjà extrêmement complexe selon les normes pharmaceutiques. Jusqu'à présent, toutes les thérapies approuvées nécessitent l'ingénierie des propres cellules T d'une personne pour exprimer les CAR. Cela prend beaucoup de temps et donc augment le coût de production des thérapies : aux États-Unis, un seul traitement avec des cellules CAR-T peut coûter environ 500 000 $US, sans compter le coût de l'hospitalisation et des traitements associés.
La création de cellules CAR-T pouvant être administrées à plusieurs personnes – souvent appelées cellules prêtes à l'emploi – a longtemps été considérée comme cruciale pour réduire le prix de la thérapie. Mais les premiers résultats suggèrent qu'il reste encore du travail à faire, déclare le bio-ingénieur Rahul Purwar de l'Institut indien de technologie de Bombay. Bien que les cellules puissent être modifiées pour réduire le risque qu'elles soient elles-mêmes éliminées par le système immunitaire, les premiers essais suggèrent qu'elles ne survivent pas longtemps après la perfusion et pourraient encore être rejetées (lire un exemple dans de Lancet). « Le prêt-à-l'emploi est une excellente approche », dit-il. « Cela arrive, mais pour le moment, nous n'en sommes pas encore là. »
La thérapie est également rarement disponible en dehors des pays riches. Au Brésil, l'hématologue Renato Luiz Guerino Cunha du groupe Oncoclínicas à São Paulo a été le premier du pays à traiter une personne avec la thérapie CAR-T en 2019. Mais les progrès ont été lents, dit-il : il n'a pas la capacité de produire rapidement de grandes quantités de cellules. « En trois ans, nous n'avons traité que six patients », dit-il. « Nous avons besoin d'une nouvelle technologie pour le traitement. »
La production d'une thérapie cellulaire CAR-T implique généralement l'utilisation d'un type de virus appelé lentivirus comme vecteur pour incorporer le gène CAR synthétique. Mais davantage de recherches sur les thérapies géniques ont accru la demande de lentivirus de qualité clinique. Les chercheurs attendent maintenant des mois et paient le gros prix pour terminer leurs expériences. Cunha produit le sien mais ne peut le faire qu'en petites quantités. Des améliorations par l'édition de gènes CRISPR pourraient aider à cet égard.
Malgré les défis, les thérapies CAR-T continuent de se développer, certains des centaines d'essais cliniques dans le monde en explorent des applications entièrement nouvelles. L'année dernière, des chercheurs ont rapporté des résultats prometteurs dans un petit essai de thérapies CAR-T pour traiter une forme de la maladie auto-immune lupus. Et dans une étude chez la souris, les chercheurs ont reprogrammé les cellules T sans la première étape habituelle consistant à les retirer du corps, créant des cellules CAR-T conçues pour éliminer les tissus cicatriciels du cœur.
En décembre, June et ses collègues ont dévoilé un moyen de rationaliser la production de cellules. Lors de la réunion annuelle de l'American Society of Hematology à la Nouvelle-Orléans, en Louisiane, l'équipe a annoncé que la réduction des délais de fabrication et de l'ingénierie des cellules CAR-T pour exprimer une protéine appelée IL-18 ont renforcé leur efficacité et permis aux chercheurs de réduire la dose de cellules administrée aux patients. « Ces patients ont eu des réponses incroyables », déclare Maus à propos de l'essai clinique, « ce qui vous indique de façon très alléchante que si vous améliorez la conception de la cellule T, vous pouvez la rendre encore plus puissante. »