NATURE NOUVELLES ET OPINIONS 26 juillet 2023
Une molécule à double tête active les voies de mort cellulaire dans les cellules cancéreuses
Des molécules ont été développées pour faire passer un facteur de transcription d'un répresseur de l'expression génique à un activateur - et ainsi capable de tuer les cellules cancéreuses. Les résultats offrent une nouvelle stratégie pour la conception de médicaments anticancéreux.
par James D. Phelan et Louis M. Staudt, du National Cancer Institute, Bethesda, USA
Les cellules cancéreuses acquièrent des altérations génétiques qui reprogramment l'expression de milliers de gènes, pour favoriser une croissance cellulaire rapide et bloquer les voies qui induisent la mort cellulaire. Gourisankar et al. décrivent dans Nature des molécules qui transforment BCL6, une protéine qui favorise le cancer en réprimant la transcription de divers gènes, en un activateur transcriptionnel. Les molécules utilisées pour induire cette transformation constituent une nouvelle classe de composés à investiguer en tant que médicaments anticancéreux potentiels.
BCL6 fonctionne comme un régulateur principal des cellules immunitaires appelées cellules B du centre germinal - qui apparaissent lors des réponses immunitaires normales, mais sont également les cellules à l'origine d'un type de cancer appelé lymphome diffus à grandes cellules B (DLBCL). Plus précisément, BCL6 réprime directement les gènes qui codent pour les inhibiteurs du cycle cellulaire et les protéines impliquées dans une forme de mort cellulaire programmée connue sous le nom d'apoptose. Cela protège les cellules B du centre germinatif et les DLBCL du stress causé par un processus de mutation programmée (hypermutation somatique des immunoglobulines) qui permet au système immunitaire de répondre efficacement aux organismes qui causent des maladies. De plus, BCL6 maintient l'identité des cellules B du centre germinatif, les empêchant de se différencier de manière irréversible en plasmocytes en réprimant le gène qui code pour la protéine BLIMP-1 réprimant la transcription. BCL6 est fréquemment dérégulé dans les DLBCL et maintient ainsi les cellules cancéreuses dans un état hautement prolifératif.
Gourisankar et ses collègues ont décidé d'essayer de modifier les effets transcriptionnels de BCL6 en s'appuyant sur un concept connu sous le nom de proximité chimiquement induite (CIP). Le CIP utilise un principe fondamental de la biologie cellulaire, à savoir que la régulation cellulaire implique souvent des mécanismes qui incitent deux protéines différentes à se rapprocher. Par exemple, le processus naturel de renouvellement des protéines implique une étape connue sous le nom d'ubiquitination, qui marque une protéine cible pour la dégradation ; cette étape est médiée par une protéine adaptatrice qui lie à la fois la cible et l'enzyme qui catalyse l'ubiquitination, les rapprochant ainsi. Ce processus de renouvellement a été exploité à des fins thérapeutiques en construisant de petites molécules appelées PROTAC, qui remplissent la fonction d'adaptateurpour cibler des protéines spécifiques à dégrader.
Dans leur étude, Gourisankar et al. ont synthétisé un composé dans lequel une molécule se liant à BCL6 est connectée à une autre molécule qui se lie à BRD4,une protéine qui active la transcription. Ce composé, premier de sa catégorie, forme un complexe avec BRD4 et BCL6 sur les sites de liaison de BCL6 dans le génome, permettant ainsi à BRD4 d'activer puissamment l'expression de gènes qui sont normalement réduits au silence par BCL6 (Fig. 1). Les auteurs ont nommé leur composé TCIP1, où TCIP signifie inducteur chimique transcriptionnel/épigénétique de proximité. Comme les auteurs l'avaient espéré, le traitement par TCIP1 de lignées cellulaires dérivées de DLBCL a régulé positivement l'expression de centaines de gènes, dont beaucoup sont connus pour être ciblés par BCL6. Encore plus extraordinaire, TCIP1 tue puissamment les cellules DLBCL exprimant BCL6 in vitro, ce qui suggère que les TCIP devraient être étudiés plus avant en tant que nouvelle classe potentielle de médicaments anticancéreux.
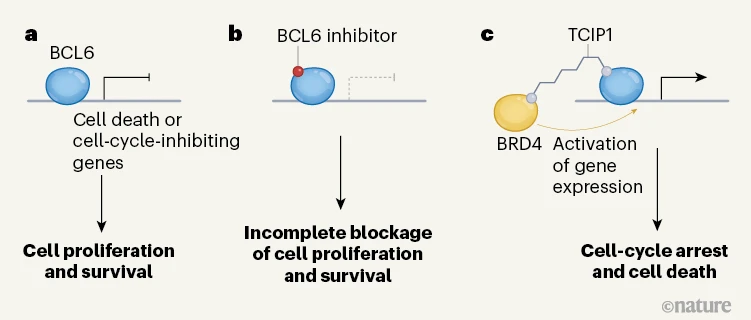
Figure 1 | Une stratégie pour modifier les effets d'un facteur de transcription. a, Le facteur de transcription BCL6 réprime l'expression des gènes qui codent pour les inhibiteurs du cycle cellulaire et les protéines qui favorisent la mort cellulaire programmée. Il favorise la prolifération et la survie de certaines cellules cancéreuses. b, Les composés qui inhibent BCL6 ou favorisent sa dégradation ont été signalés comme des agents anticancéreux potentiels, mais la prolifération et la survie cellulaires sont incomplètement bloquées à moins que toutes les molécules BCL6 ne soient inhibées ou dégradées. c, Gourisankar et al. ont synthétisé un composé appelé TCIP1, dans lequel un groupe de liaison à BCL6 est connecté à un autre groupe qui lie BRD4, une protéine qui active la transcription. TCIP1 forme un complexe avec BRD4 et BCL6 sur les sites de liaison de BCL6 dans le génome, permettant ainsi à BRD4 d'activer puissamment l'expression de gènes qui sont normalement réduits au silence par BCL6. De cette façon, TCIP1 tue puissamment les cellules cancéreuses exprimant BCL6 in vitro.
De nombreux composés ont été identifiés qui inhibent ou dégradent BCL6, atténuant ainsi la répression de ses gènes cibles et tuant les cellules DLBCL in vitro. Cependant, comme ces composés agissent par un mécanisme de «perte de fonction», ils peuvent nécessiter une inhibition presque complète de BCL6 pour être efficaces. En revanche, TCIP1 utilise un mécanisme de «gain de fonction», ce qui signifie que seule une fraction de BCL6 cellulaire pourrait avoir besoin d'être engagée pour exercer les effets du composé. Cela pourrait être utile pour le traitement de tumeurs volumineuses et mal vascularisées dans lesquelles il est difficile d'atteindre des concentrations élevées de médicament.
Gourisankar et al. ont observé que, en plus de réguler à la hausse l'expression de nombreux gènes suppresseurs de tumeurs, TCIP1 régule également à la baisse MYC (un gène promoteur de tumeur qui code pour un facteur de transcription) et bon nombre de ses cibles transcriptionnelles - ce qui pourrait contribuer à la toxicité exceptionnelle de cet agent pour cellules de lymphome. Les mécanismes sous-jacents à la régulation négative de MYC par TCIP1 ne sont pas clairs, mais une possibilité est que le composé régule à la hausse la cible BCL6 BLIMP-1, qui réprime alors MYC. Alternativement, TCIP1 pourrait recruter BCL6 sur certains gènes ciblés par BRD4, y compris MYC, réprimant ainsi leur expression. Cette complexité mécanistique illustre que les TCIP doivent être soigneusement examinés expérimentalement pour discerner comment ils modifient l'expression des gènes et les résultats biologiques.
La nouvelle étude met en évidence le potentiel de TCIP1 en tant que thérapie DLBCL, mais des travaux supplémentaires sont nécessaires pour déterminer quels sous-types de ce cancer répondront. Cela pourrait être dicté par l'activité de répression de la transcription de BCL6, qui est la plus élevée dans un sous-type génétique de DLBCL (le sous-type EZB). Il est important de noter que TCIP1 pourrait avoir une activité clinique dans d'autres lymphomes exprimant BCL6, tels que le lymphome folliculaire et le lymphome de Burkitt, et dans le lymphome à cellules T angioimmunoblastique (qui est dérivé de cellules immunitaires exprimant BCL6 connues sous le nom de cellules auxiliaires folliculaires T).
Lors du développement d'un nouvel agent en tant que médicament anticancéreux, une considération précoce est de savoir comment l'associer à des médicaments approuvés pour obtenir une synergie mécaniste et une meilleure efficacité clinique. Etant donné que TCIP1 induit l'expression des protéines pro-apoptotique BIM et NOXA, il semble logique de l'associer à d'autres agents favorisant l'apoptose. D'un autre côté, parce que TCIP1 induit l'arrêt du cycle cellulaire, il pourrait contrer l'effet de certains agents anticancéreux qui nécessitent une progression du cycle cellulaire pour leur efficacité.
Une autre considération cruciale lors de l'évaluation de nouveaux médicaments anticancéreux est la possibilité de produire des effets secondaires cliniques inacceptables. Dans le cas de TCIP1, il y a des raisons de s'inquiéter parce que BCL6 est exprimé dans les cellules du système immunitaire inné et parce que les souris génétiquement modifiées dépourvues de BCL6 subissent une inflammation sévère (ref1)(ref2). Les auteurs ont abordé ce problème de front et n'ont trouvé aucune preuve d'inflammation induite par TCIP1 chez les souris de type sauvage traitées - pas même dans la rate, dans laquelle la régulation à la hausse des gènes ciblés par BCL6 était particulièrement élevée. Néanmoins, les essais cliniques de TCIP1 ou de molécules apparentées doivent faire attention aux éventuels effets secondaires inflammatoires.
Dans quelle mesure l'approche TCIP est-elle généralement applicable ? Les facteurs de transcription sont souvent dérégulés dans le cancer, mais contrairement à BCL6, la majorité de ces facteurs activent la transcription. Tout TCIP conçu pour cibler ces facteurs devrait donc recruter un répresseur transcriptionnel, ce qui n'est en principe pas plus difficile à faire que de recruter un activateur. Une autre considération lors du choix d'un facteur de transcription à cibler avec un TCIP est l'activité relative de ce facteur dans les cellules malignes par rapport aux cellules non malignes. Une spécificité élevée du cancer pourrait être possible dans certains cas, mais pas dans d'autres. Dans l'ensemble, le développement des TCIP ne sera limité que par l'imagination des biologistes du cancer et l'innovation des chimistes. De tels efforts promettent de mettre fin à la perception selon laquelle les facteurs de transcription favorisant le cancer ne peuvent pas être ciblés par les médicaments.