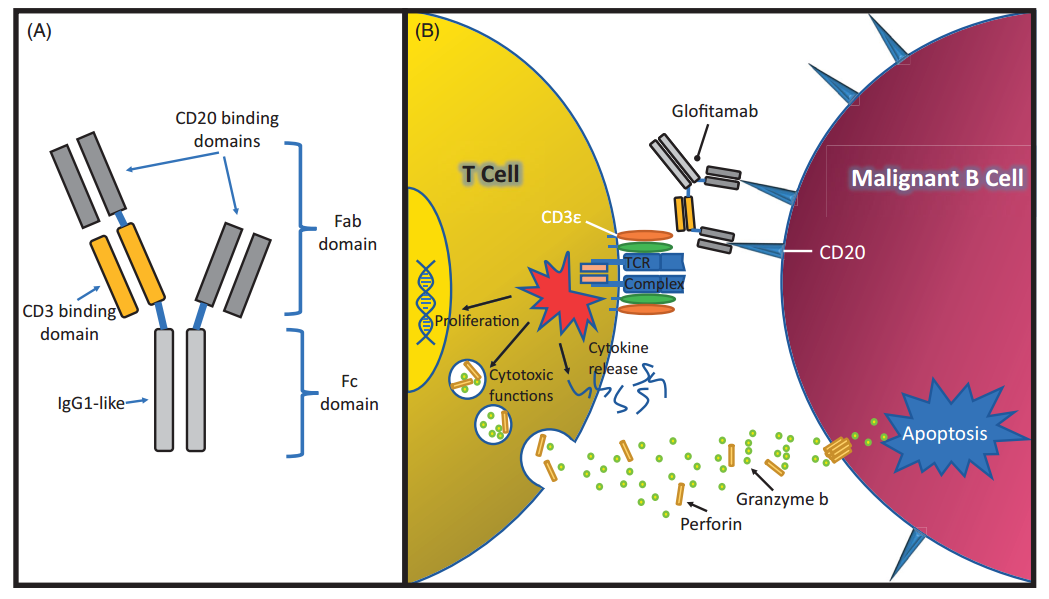
Traitement de lymphomes non-hodgkiniens résistants à la thérapie CAR-T par le glofitamab (Columvi, Roche)
Nous avons résumé récemment une revue des thérapies CAR-T. Dans la majorité des cas, les lymphomes non-hodgkiniens sont dus à la prolifération de lymphocytes B anormaux. Les lymphocytes B sont les cellules du système lymphatique responsables de l'immunité humorale, c'est à dire de la production d'anticorps. Le lymphome non-hodgkinien le plus fréquent est le lymphome diffus à grandes cellules B (DLBCL). Les lymphocytes B cancéreux ainsi que les lymphocytes B normaux expriment une protéine de surface membranaire appelée CD19 qui est la cible habituelle de la thérapie CAR-T. Pour rappel, cette thérapie consiste à prélever les lymphocytes T du patient et de les instrumenter pour leur ajouter un récepteur transmembranaire qui est capable de se fixer aux protéines CD19, et ce faisant d'activer ces lymphocytes T.
Les lymphocytes T participent également à l'immunité. L'immunité cellulaire cette fois. Ils sont de deux types principaux : les lymphocytes T auxilliaires (ou CD4+) reconnaissent les cellules qui ont été infectées par un agent pathogène, tel un virus, et communiquent avec les autres éléments de l'immunité, notamment les lymphocytes B, pour qu'ils produisent les anticorps nécessaires, et les lymphocytes T cytotoxiques (ou CD8+) qui vont détruire les cellules infectées.
Le but de la thérapie CAR-T est de rediriger l'immunité cellulaire due aux lymphocytes T, non pas contre un agent pathogène extérieur ou contre une cellule déjà infectée par ce pathogène, mais contre une cellule cancéreuse, à savoir ici les cellules du lymphome, que les lymphocytes cytotoxiques vont détruire. Bien évidemment, la protéine de surface CD19 étant présente ausi dans les lymphocytes B normaux, ceux-ci seront aussi détruits par le traitement, mais les personnes peuvent vivre sans lymphocytes B.
Toutefois, après traitement par thérapie CAR-T, on observe des cas de rechute ou de résistance. Cette résistance est très souvent due au fait qu'un certain nombre des cellules cancéreuses du lymphome perdent leur proteine de surface CD19, et donc ne peuvent plus être la cible des lymphocytes T porteurs du récepteur anti-CD19.
Depuis 2020, divers essais cliniques sont en cours pour tenter de palier à ces traitements inefficaces. Notamment en instumentant les lymphocytes T pour qu'ils reconnaissent deux proteines des cellules du lymphome. L'essai ALEXANDER, visant à la fois CD19 et CD22 en est un exemple. Mais surtout, en octobre 2021, la Commission Européenne a approuvé le glofitamab de Roche, en tant que médicament orphelin pour traiter les lymphomes diffus à grandes cellules B (DLBCL) résistants aux autres thérapies, et en particulier au traitement CAR-T. Le glofitamab est un anticorps "à double tête", CD3xCD20. À savoir qu'il se lie à la fois à la protéine de surface CD3 des lymphocytes T et à CD20 des lymphocytes B. Il peut donc, d'une part réactiver les cellules CAR-T injectées précédement, mais aussi activer les lymphocytes T normaux du patient, en les liant aux cellules cancéreuses.
Les résultats d'une étude d'efficacité sur 107 patients, lesquels avaient déjà reçu au moins deux thérapies, sans succès, dont 1/3 avaient reçus une thérapie CAR-T et s'étaient avérés résistants, sont les suivants : après 9 mois, 50% des patients voient une amélioration de leurs symptômes, et chez 35%, une rémission complète est observée. Parmi ceux ayant eu une rémission complète à 9 mois, 92% sont encore en vie un an après le traitement.
Bien évidemment, les effets secondaires liés au traitement sont similaires à un traitement CAR-T, à savoir principalement de fortes fièvres et fatigue, dues à une production intense de cytokines, liées à l'effet thérapeutique, de possibles effets neurologiques transitoires, et une réduction des globules blancs, des plaquettes ainsi qu'une anémie.