BLOTS ON A FIELD ?
UN DOMAINE ENTACHÉ DE SUSPICION ?
Il s'agit de la maladie d'Alzheimer, une maladie encore très mal connue sur le plan biochimique, et même sur ses causes réelles.
Et heureusement, la communauté scientifique internationale fait sa propre police, ses propres enquêtes pour débusquer des fraudes ou des malversations, rares, mais malheureusement existantes, et ces derniers temps, le journal Science a publié les observations d'un enquêteur et lanceur d'alerte, ayant débusqué très probablement (un comité d'experts devra statuer) des malversations concernant la théorie considérée jusqu'ici comme la plus crédible, avancée par un laboratoire universitaire américain, et utilisée en ce moment par une petite société spécialisée pour développer des médicaments qui sont en cours d'essais cliniques. Dans le climat général de suspicion par rapport au monde scientifique suite à la pandémie de SARS-CoV-2, il est heureux que le monde scientifique se montre ainsi aussi vigilant.
J'annonce tout de suite que je suis loin d'être un expert, c'est un domaine de recherche extrêmement complexe et diversifié, et il me faudrait certainement des semaines pour en faire le tour, ne fut ce que pour en avoir un bon aperçu.
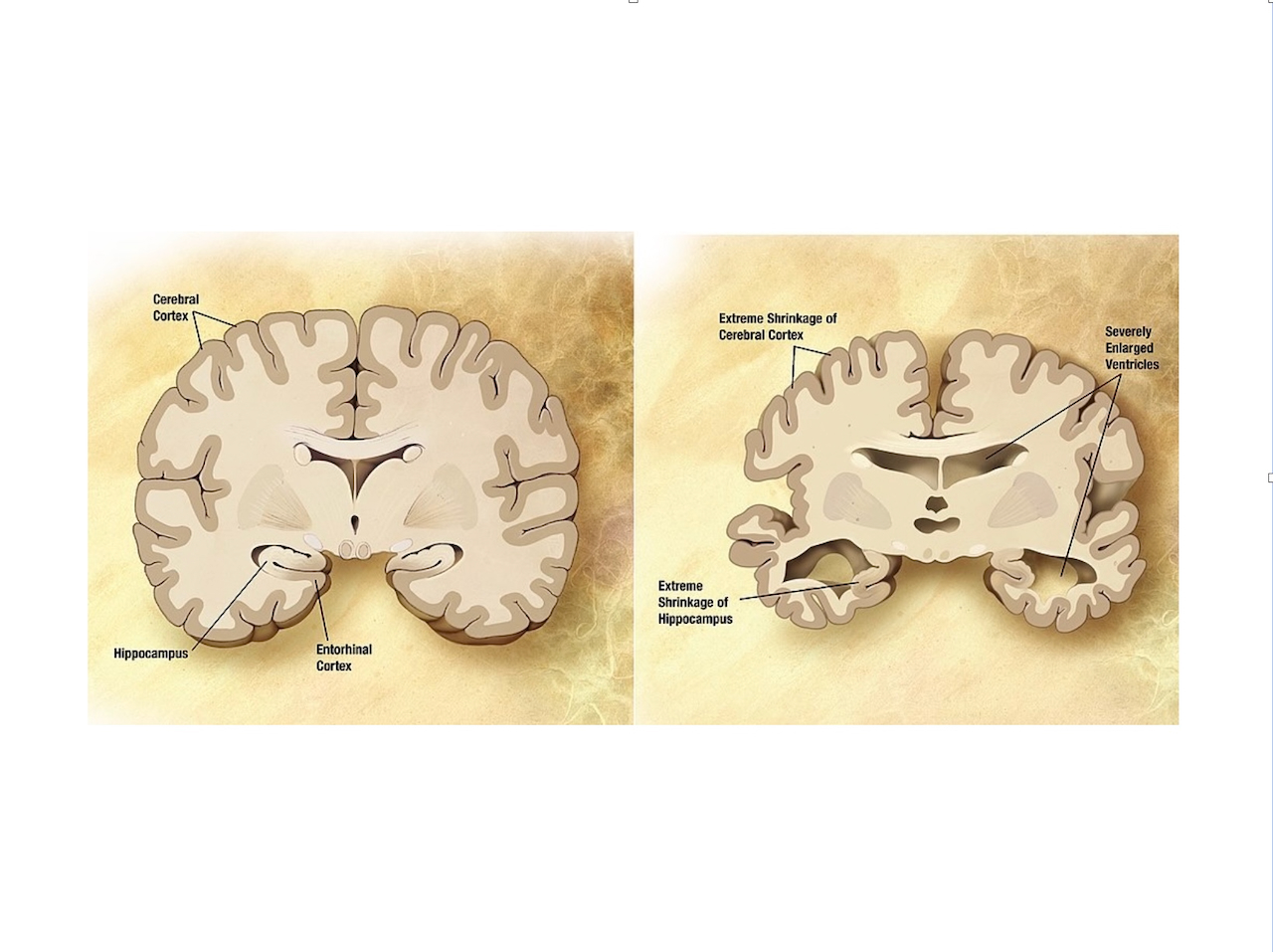
Je ne reviendrai pas sur les symptômes et l'évolution de la maladie. Je pense que ça, c'est connu de tous.
Ça fait maintenant bien plus d'un siècle, en 1907, que le Docteur Aloïs Alzheimer a décrit le cas d'une première patiente qu'il a suivi sur des années, noté l'évolution de ses déficits cognitifs, et examiné post-mortem, son cortex cérébral, dans lequel il a noté non seulement qu'il était largement dégénéré, mais aussi qu'il comportait des structures atypiques sous formes d'amas.
Il faudra encore attendre 20 ans pour caractériser la structure de ces amas faits de plaques amyloïdes, et ce n'est que dans les années '80 qu'on en comprendra l'origine.
Toutes les cellules de l'organisme comportent des protéines trans-membranaires (c'est à dire qu'une partie se situe à l'intérieur de la cellule, une autre à l'extérieur, et fatalement, une petite partie est associée à la membrane cellulaire. Ces protéines sont appelées communément APP (pour "Amyloid Precursor Protein"). Elles sont particulièrement abondantes dans les neurones du cortex cérébral.
Fait très important, elles sont conservées au cours de l'évolution des espèces, et on les retrouve chez la mouche par exemple. Il est donc certain qu'elles jouent un rôle clé, mais encore mal compris. Elles pourraient intervenir dans le développement du système nerveux périphériques, dans la survie des neurones, dans la mémoire. De nombreuses hypothèses sont à l'étude, mais rien n'est totalement clair.
Chez une personne saine, la protéine APP se clive une première fois dans sa partie extérieure, la plus longue, en une position proche de la membrane, grâce à une enzyme appelée 𝛂-secrétase, puis une seconde fois, dans la partie intra-membranaire, 26 acides aminés plus loin, par une 𝛾-secrétase, donnant donc lieu, outre le long peptide provenant de la partie externe, dont le rôle n'est pas encore éclairci en ce moment, à un petit peptide de 26 acides aminés, appelé P3, et qui ne provoque aucune toxicité ni agrégat dans le cortex.
Par contre, chez les personnes atteintes de la maladie d'Alzheimer, si la 𝛾-secrétase joue bien son rôle dans la partie située dans la membrane, l'𝛂-secrétase est remplacée par une 𝛽-secrétase, coupant le peptide un peu plus à l'écart de la membrane, donnant lieu à une petit peptide, cette fois de 42 acide aminés, appelé A𝛽*42, et responsable de la formation des agrégats, appelés plaques amyloïdes.
Cette découverte a soulevé un intérêt énorme dans la communauté scientifique spécialisée dans cette pathologie, et la recherche de médicaments pouvant inhiber la 𝛽-secrétase est devenue rapidement la quête du Graal, de nombreuses équipes universitaires ou privées se sont lancées sur cette piste, et bien sûr de nombreux crédits publics ou de nombreux investisseurs privés ont été recherchés pour financer ces travaux.
Jusqu'ici, aucune de ces nombreuses recherches n'a permis d'aboutir à une solution thérapeutique. Il faut noter, et ceci est une remarque personnelle, mais je suis loin d'être le seul à soulever ce point, que personne ne peut affirmer avec certitude que la production de plaques amyloïdes est la cause de la maladie d'Alzheimer, et pas une conséquence de celle-ci.
Quand dans les années 2000, j'étais encore actif dans la recherche pharmaceutique, il m'arrivait de lire des articles ou d'assister à des conférences sur la maladie d'Alzheimer, bien que je n'aie jamais été directement impliqué dans ces axes de recherche.
Deux mécanismes étaient alors couramment évoqués pour tenter d'expliquer la pathologie. Le premier était celui que nous venons d'évoquer, des plaques amyloïdes.
Le second était l'accumulation de protéines tau déformées dans les neurones des malades, principalement au niveau des axones des neurones. Dans toutes les cellules, il existe un squelette interne, appelé cytosquelette pour donner sa forme à la cellule et l'empêcher de s'écraser sur elle même. Ce cytosquelette est fait de microtubules, eux-mêmes constitués de protéines. Dans les axones des neurones, les microtubules sont recouverts d'une protéine appelée tau (pour tubulin-associated unit) qui servent à rendre les microtubules plus flexibles, les axones ayant besoin d'une plus grande plasticité pour se lier au neurone suivant, créant ainsi un enchaînement de neurones transporteurs d'une information. L'accumulation de ces protéines tau déformées, ne pouvant plus jouer leur rôle autour des microtubules est aussi considérée comme une cause de toxicité neuronale, un peu comme le sont les prions dans la maladie de la vache folle.
En bon béotien que j'étais, je ne comprenais pas le rapport entre les deux observations. J'ai donc levé le doigt à plusieurs reprises pour demander quel était le mécanisme moléculaire qui reliait les protéines tau à la production de A𝛽*42, et par là, aux plaques amyloïdes. Aucune réponse ne pouvait m'être fournie, et toujours en parfait béotien, je commençais à me demander si la maladie d'Alzheimer n'était pas en fait une espèce de fourre-tout dans lequel on englobait des démences provenant de causes différentes, mais induisant les mêmes symptômes cliniques.
Si tel était le cas, on était certainement loin de trouver un traitement, me disais-je, toujours en parfait béotien.
Depuis, de nombreux autres mécanismes ont été évoqués pour tenter d'expliquer la maladie d'Alzheimer. Notamment, la mutation de gènes, l'immunité innée dans des cas de maladies d'Alzheimer répandue dans une même famille, une maladie auto-immune, des processus inflammatoires, l'hyperlipidémie (trop de graisses) ou l'hyperglycémie (trop de sucres) au niveau du cerveau, etc .... Des recherches sont poursuivies dans tous ces domaines, et bien sûr, des fonds sont alloués à toutes ces recherches. Sans succès jusqu'ici.
Et puis, en 2006, un article révolutionnaire sort dans le prestigieux journal Nature. Venant d'une équipe de l'Université du Minnesota, dirigée par Karen Ashe, une chercheuse prestigieuse pour avoir fait partie de l'équipe ayant identifié les prions. Le premier auteur, et visiblement l'auteur de la découverte décrite, est Sylvain Lesné un postdoctorant français, qui suite à cette découverte poursuit maintenant une brillante carrière aux États-Unis. De quoi s'agit-il ? Lesné a identifié chez le rat un résidu peptidique inconnu jusqu'alors, A𝛽*56, plus long donc que le très souvent décrit A𝛽*42, et induisant clairement chez le rat une neurodégénérescence et des problèmes cognitifs. Lesné déclare que la sécrétion de ce peptide hautement toxique est la cause ultime de la maladie d'Alzheimer. Cet article est une bombe parmi les spécialistes, et de nombreux chercheurs se lancent donc à leur tour sur la piste, en obtenant bien évidemment facilement des fonds, notamment du NIH (National Institutes of Health). Et actuellement, une petite société spécialisée a repris cette hypothèse et a développé un médicament contre la production de A𝛽*56 qui est actuellement en essais cliniques.
SAUF QUE, d'abord, personne n'a reproduit les observations de Lesné, que A𝛽*56 n'a jamais été observé chez l'homme, et qu'un lanceur d'alerte du monde scientifique, soutenu par de nombreux autres, a montré que de nombreuses images d'expériences de Westen blot, une technologie permettant de mettre en évidence des protéines particulières parmi toutes les autres figurant dans un milieu biologique et de les quantifier, étaient manifestement trafiquées de façon à supporter la thèse avancée. Cet enquêteur précise toutefois qu'il n'a travaillé qu'à partir des images publiées, et qu'il n'a pas eu accès aux images originales à haute définition. Il a soumis le résultat de ces enquêtes au NIH, mais devant la lenteur de l'administration, il a soumis tous les résultats de son enquête au journal Science, qui a publié un long article sur le sujet, article dont je reprends la traduction sur mon site web, et que vous trouverez en cliquant sur le lien ci-dessous.
Cet article de Science, qui tend à indiquer une malversation majeure dans un domaine de première importance, indiquant un mécanisme qui risque bien de n'être qu'une chimère, mais pour lequel de milliards de dollars d'argent public ont été investi, a très vite été relayé par les quotidiens grand-public. En même temps que je découvrais l'article de Science, j'en lisais des compte-rendus à la fois dans le New York Times et dans Le Monde.