Avec plusieurs biomarqueurs (Note 1) de la maladie d'Alzheimer disponibles dans les fluides biologiques, la recherche d'homologues dans la maladie de Parkinson (MP) et la démence à corps de Lewy (DCL) est maintenant lancée. Quatre nouveaux articles, publiés en août et septembre 2023, présentent deux candidats : la DOPA décarboxylase (DDC), l'enzyme qui convertit la lévodopa en dopamine, et les altérations de l'ADN mitochondrial (oxydations, mutations, délétions).
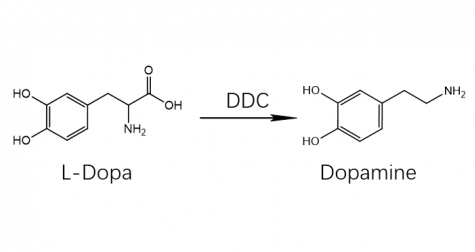 Dans Nature Communications du 13 septembre, des chercheurs dirigés par Charlotte Teunissen des Medical Centers de l'Université d'Amsterdam (Ref.1), ont rapporté que des niveaux élevés de DDC dans le liquide céphalo-rachidien (Cerebrospinal Fluid ou CSF) distinguaient les personnes atteintes de DCL des témoins. Per Svenningsson, du Karolinska Institutet, à Stockholm, a trouvé la même chose dans la MP, comme indiqué dans le numéro du 4 septembre de Translational Neurodegeneration (Ref.2). Il en a été de même pour Oskar Hansson, de l'Université de Lund, en Suède, pour la DCL et pour la MP. Dans Nature Aging du 18 septembre, son groupe a également rapporté que la DDC était présente dans le sang des personnes atteintes de ces maladies et que la DDC dans le CSF permettait de prédire une progression dans les trois ans chez les personnes atteintes de DCL ou de MP, encore au stade préclinique, c’est à dire avant que les premiers symptômes n’apparaissent (Ref.3).
Dans Nature Communications du 13 septembre, des chercheurs dirigés par Charlotte Teunissen des Medical Centers de l'Université d'Amsterdam (Ref.1), ont rapporté que des niveaux élevés de DDC dans le liquide céphalo-rachidien (Cerebrospinal Fluid ou CSF) distinguaient les personnes atteintes de DCL des témoins. Per Svenningsson, du Karolinska Institutet, à Stockholm, a trouvé la même chose dans la MP, comme indiqué dans le numéro du 4 septembre de Translational Neurodegeneration (Ref.2). Il en a été de même pour Oskar Hansson, de l'Université de Lund, en Suède, pour la DCL et pour la MP. Dans Nature Aging du 18 septembre, son groupe a également rapporté que la DDC était présente dans le sang des personnes atteintes de ces maladies et que la DDC dans le CSF permettait de prédire une progression dans les trois ans chez les personnes atteintes de DCL ou de MP, encore au stade préclinique, c’est à dire avant que les premiers symptômes n’apparaissent (Ref.3).
Des scientifiques dirigés par Laurie Sanders, de la faculté de médecine de l'université Duke, à Durham, en Caroline du Nord, ont mesuré les dommages causés à l'ADN mitochondrial (Note 2) dans les cellules sanguines. Dans le Science, Translational Medicine du 30 août, ils ont rapporté que les cellules sanguines des personnes atteintes de MP et des porteurs non symptomatiques d'une mutation provoquant la MP présentaient plus de dommages à l'ADN mitochondrial que les témoins (Ref.4).
« Un biomarqueur sanguin est absolument nécessaire pour les synucléinopathies, car les modalités actuelles impliquent soit des procédures lourdes, par exemple une ponction lombaire pour le CSF ou une biopsie cutanée, soit une imagerie cérébrale coûteuse », a écrit Lawren VandeVrede, Université de Californie à San Francisco.
Les options de diagnostic actuelles de la MP incluent des méthodes spectroscopiques très spécifiques et coûteuses pour détecter l’activité de transport de la dopamine dans les neurones dopaminergiques, ou des techniques d’amplification des agrégats d’α-synucléine dans le CSF. Hansson a utilisé un test d'amplification d’agrégats de l'α-synucléine dans le CSF par comparaison avec le CSF d’individus contrôles. Ces agrégats, tout comme dans d’autres neurodégénérescences, sont dus à une phosphorylation inadéquate et à un mauvais reploiement et de la protéine. C’est le cas par exemple pour le prion de la maladie de Creutzfeldt-Jakob, pour laquelle un test d’amplification des prions, appelé RT-QuIC (pour Real-time quaking-induced conversion) avait été mis au point dans le CSF. Un test similaire a été adapté aux agrégats d’α-synucléine (Ref.5), et a été utilisé par l’équipe d’Oskar Hansson.
Dans l’étude d’Amsterdam, les échantillons de CSF proviennent de 109 personnes atteintes de DCL, 235 atteintes de la maladie d'Alzheimer et 190 témoins provenant de trois groupes de patients d’Amsterdam et de Pennsylvanie. La plupart des participants avaient entre 50 et 60 ans ; 65 pour cent étaient des hommes.
La protéine la plus positivement régulée (augmentation de son taux) dans la DCL était la DDC, distinguant les patients des témoins avec à la fois une sensibilité et une spécificité hautement significative. La DDC dans le CSF a également séparé la DCL de la maladie d'Alzheimer de façon presqu’aussi spécifique, ce qui suggère qu'il s’agit bien d'un marqueur spécifique des maladies à corps de Lewy.
La DDC est également en tête de la liste dans l’étude protéomique (Note 3) du CSF de Svenningsson dans la maladie de Parkinson. Le CSF de 117 témoins, 132 personnes atteintes de MP et 67 atteintes de troubles parkinsoniens atypiques, dont 24 avec une atrophie multisystémique (MSA), 21 avec une paralysie supranucléaire progressive (PSP) et 22 avec un syndrome corticobasal (CBS). Les échantillons provenaient de deux groupes de patients de Suède et de Californie.
Parmi les six principales protéines du CSF régulées positivement dans la MP, la principale était de loin la DDC, qui montrait le plus grand potentiel diagnostique, distinguant les personnes atteintes de MP des témoins de façon très sélective. La DDC était également élevé dans le CSF provenant de personnes atteintes de troubles parkinsoniens atypiques, ce qui laisse entendre qu'il pourrait s'agir d'un biomarqueur plus large de maladies neurodégénératives avec déficits en dopamine.
Les conclusions de Hansson concordent avec cette idée. Dans leur étude plus vaste, ils ont analysé les protéines du CSF de 682 participants suédois : 347 témoins, 33 personnes atteintes de DCL, 48 atteintes de MP, 40 atteintes de troubles parkinsoniens atypiques, 172 personnes atteintes de la maladie d’Alzheimer, 23 atteintes démences frontotemporales et 19 atteintes de démence vasculaire.
Encore une fois, la DDC était la protéine du CSF la plus régulée positivement dans la DCL et d'autres troubles parkinsoniens. L’étude a identifié la DCL et la MP, regroupées sous le nom de maladies à corps de Lewy (MCL), par rapport aux témoins avec une précision de 89%, et les troubles de Parkinson atypiques avec une précision de 79% par rapport aux témoins. La DDC dans le CSF a également distingué les MCL des trois maladies neurodégénératives non parkinsoniennes avec une précision de 83%. Les auteurs soupçonnent que les neurones pourraient produire davantage de DDC pour compenser les faibles niveaux de dopamine, d'où la régulation positive du marqueur uniquement dans les troubles parkinsoniens.
Hansson était initialement sceptique quant au fait que la DDC soit si élevée dans les MCL. Il pensait que cela pourrait être lié au traitement. Les personnes atteintes de MP prennent généralement de la lévodopa et un inhibiteur de la DDC restant dans la circulation périphérique (incapable de pénétrer dans le cerveau), permettant à la majeure partie du précurseur de la dopamine de pénétrer dans le cerveau. Cet afflux de lévodopa pourrait-il augmenter la production de DDC ? Même si la protéine était en effet plus élevée chez les participants souffrant de maladies à corps de Lewy, prenant des médicaments que chez ceux qui n'en prenaient pas encore, la DDC restait la protéine du CSF la plus régulée positivement chez les patients non traités, ce qui signifie que la maladie était à l'origine du changement de ce biomarqueur. De même, les équipes de Svenningsson et Teunissen ont constaté un taux élevé de DDC dans le CSF chez les participants atteints de la maladie de Parkinson mais non traités, et des taux encore plus élevés chez ceux prenant de la lévodopa et un inhibiteur de la DDC périphérique.
Surtout, la DDC a permis de détecter les maladies à corps de Lewy (MCL) précliniques, c’est à dire quand aucun symptôme n’est encore détectable, et prédire la progression lorsqu’il est associé à un test d’amplification des agrégats d’α-synucléine par RT-QuIC. Parmi les 347 contrôles, 35 ont été testés positifs pour les agrégats d'α-synucléine, ce que Hansson et ses collègues ont interprété comme signifiant une MCL préclinique. La DDC était déjà élevé dans leur CSF, ce qui les distinguait des témoins. Sur trois ans, 12 d’entre eux ont développé des symptômes, et ceux présentant les niveaux de DDC dans le CSF les plus élevés étaient 3,7 fois plus susceptibles de progresser que leurs homologues ayant de faibles niveaux de DDC. « Si une personne souffre à la fois d'une pathologie à corps de Lewy et d'un trouble du système dopaminergique, elle est sur le point de développer des symptômes », a conclu Hansson.
Des niveaux élevés de DDC dans le CSF étaient également corrélés à une moins bonne cognition et à une moins bonne mémoire dans les cas de MCL, tels que mesurés par les tests pré cliniques de détection de maladie d’Alzheimer (mPACC) et l’échelle de sévérité de la partie cognitive de la maladie d’Alzheimer (ADAS-Cog).
Hansson envisage de combiner les tests de la DDC et de l’α-synucléine dans le CSF en clinique. Une personne testée positive pour les deux souffrirait probablement de MCL (MP et DCL), tandis qu'une personne avec seulement une DDC élevée souffrirait d'un trouble parkinsonien atypique, car les corps de Lewy ne se développent pas au cours de ces maladies (plus exactement, la MSA est aussi une synucléinopathie, tandis que les PSP et CBS sont des taupathies).
Un biomarqueur sanguin serait préférable pour un usage clinique. Et la DDC dans le plasma ? Cette recherche ne fait que commencer, mais jusqu'à présent, parmi 33 personnes atteintes de MCL, 56 atteintes de troubles atypiques de Parkinson et 54 témoins, ayant beaucoup de DDC plasmatique, ont identifié la MCL avec une précision de 92% et les troubles parkinsoniens atypiques avec une précision de 85%. « Nous avons besoin de biomarqueurs sanguins pour ne pas dépendre du CSF pour les dépistages à grande échelle à l'avenir », a écrit Brit Mollenhauer, du centre médical universitaire de Göttingen, en Allemagne.
Existe-t-il d’autres facteurs dans le sang qui pourraient signaler la MP ? Sanders et ses collègues ont emprunté une voie différente, en analysant les dommages causés à l'ADN mitochondrial (ADNmt), plutôt qu'aux protéines, dans les cellules sanguines. Les dommages mitochondriaux sont importants dans la maladie de Parkinson, avec une élimination défectueuse de ces organites anciens ou altérés et une accumulation ultérieure de leurs morceaux altérés à l'origine de la maladie ( revue de Malpartida et al., 2021 (Ref.6) et très récemment : E. Tresse et al., Nature, 2 octobre 2023 (Ref.7) ).
Pour mesurer les dommages causés à l'ADN mitochondrial, le laboratoire de Laurie Sanders de l'Université de Dundee au Royaume-Uni ont développé un test basé sur la PCR qui quantifie la quantité d'ADNmt présente dans les cellules. L’hypothèse est que plus le test détecte d’ADNmt intact, moins il a été endommagé ou détruit. Ils ont analysé les cellules mononucléaires du sang périphérique dans des échantillons provenant de 22 témoins, 58 personnes atteintes de MP, dont 28 porteuses de la mutation G2019S du gène LRRK2 provoquant la MP, et 17 porteurs non symptomatiques. Sanders avait déjà lié cette variante de LRRK2 aux dommages de l'ADNmt dans les neurones humains en culture ( Sanders et al., 2014 (Ref.8) ).
Par rapport aux cellules sanguines des témoins, les cellules des patients parkinsoniens présentaient 50 % en plus de dommages à l’ADNmt. Il en a été de même pour les porteurs asymptomatiques de LRRK2, indiquant donc des dommages mitochondriaux très au début de la pathogenèse. « Il reste à déterminer si ces porteurs de mutations LRRK2 non symptomatiques développent une maladie de Parkinson clinique », écrivent les auteurs.
La quantité d’altérations du génome mitochondrial distinguait la MP, avec ou sans la mutation LRRK2, des témoins, affichant des sélectivités élevées et similaires selon la présence ou l’absence de la mutation. Le marqueur était toutefois moins précis chez les porteurs asymptomatiques, la spécificité passant de 85% à 74%.
Au final, la concentration de DDC dans le CSF ou le plasma et les dommages à l’ADNmt dans les cellules sanguines offrent deux marqueurs potentiels de la MP et d’autres troubles neurodégénératifs dopaminergiques.
Références
- Marta del Campo et al., Nat Commun 14, 5635 (2023)
- Wojciech Paslawski et al., Translational Neurodegeneration 12, 42 (2023)
- Joana B. Pereira et al., Nature Aging, Letter, 18 September 2023
- Rui Qi et al., Science Translational Medecine, 15, 30 August 2023
- Connor Bargar et al., Acta Neuropathol Commun 9, 62 (2021)
- Ana Belen Malpartida et al., Trends in Biochemical Sciences, 46, 329 (2021)
- Emilie Tresse et al., Mol Psychiatry (2 October 2023)
- Laurie Sanders et al., Neurobiology of Disease 62, 381-386 (2014)
Notes
- Un biomarqueur est une molécule circulant dans un fluide biologique (sang, liquide céphalorachidien, urine ...) ou même dans certains tissus, qui suggèrent l'existence d'une pathologie. Cette molécule n'est pas nécessairement ni la cause, ni la conséquence de la pathologie. Elle peut tout aussi bien apparaître dans un processus biochimique qui se produit en parallèle avec la pathologie. Plutôt qu'une molécule, le biomarqueur peut également être une altération d'un paramètre physiologique (modification de certains paramètres sanguins, comme la formule leucocytaire, modification du nombre de plaquettes ..., modification de la tension artérielle ...). A contrario, des biomarqueurs sont aussi recherchés pour rapidement mettre en évidence l'efficacité d'un traitement visant une pathologie particulière. Il est de moins en moins rare de mesurer la variation de certains biomarqueurs dès les études cliniques de Phase I d'un nouveau traitement, alors que cette phase ne vise pas à démontrer l'efficacité (analysée dans les études de Phase II et de Phase III), mais la tolérance au traitement, l'établissement d'effets secondaires éventuels, et l'étude de la pharmacocinétique du médicament étudié, c'est à dire ses concentrations dans le sang en fonction du temps suivant son administration. L'ajout de biomarqueurs à ce stade permet déjà d'augmenter la confiance que l'on peut avoir quand à l'efficacité qui pourra être observée en Phase II, et surtout de pouvoir mieux ajuster les doses à utiliser en Phase II.
- Nos cellules de contiennent pas que de l'ADN dans leur noyau, lequel forme les chromosomes et contient les gènes formant notre patrimoine génétique, et contenant l'information nécessaire à la synthèse de nos protéines. Les mitochondries, qui sont des organelles présentes dans le cytoplasme des cellules, et dont le rôle est de produire l'énergie nécessaire au fonctionnement de la cellule, contiennent aussi leur propre ADN, bien que de taille nettement plus petite que l'ADN nucléaire. Celui-ci contient les gènes nécessaires au fonctionnement propre de la mitochondrie, et ne se recombine jamais avec l'ADN nucléaire. Chose très particulière : alors que l'ADN nucléaire provient pour moitié du père et pour moitié de la mère, l'ADN mitochondrial (ADNmt) est uniquement transmis par la mère. Il joue donc un grand rôle dans les études de populations, de migrations et de l'évolution de l'homme.
- Tout comme la génomique est une approche analytique moderne permettant d'analyser un grand nombre de gènes en parallèle pour savoir lesquels voent leur expression sur-régulée (augmentée) ou sous-régulée (diminuée), en étudiant la quantité d'ARN messager produits par tous ces gènes, la protéomique est également une approche analytique en continuel développement, qui permet d'analyser la sur- ou la sous-régulation de protéines, en particulier les enzymes et les récepteurs membranaires. Dans bien des cas, elle offre un avantage sur la génomique, en ce sens qu'un même ARN messager peut être traduit en plusieurs protéines différentes, ce que la génomique ne peut distinguer. Longtemps la protéomique était une approche analytique lente et complexe, faisant principalement appel à la spectrométrie de masse. De nombreux progrès ont vu le jour au cours de ces dernières années, notamment grâce à l'emploi d'anticorps spécifiques de protéines. Ces anticorps sont reliés à une chaîne d'ADN qui peut être amplifiée par PCR. On en est aujourd'hui à détecter très spécifiquement une protéine grâce à deux anticorps différents, dont les chaînes d'ADN comportent deux morceaux d'ADN complémentaires qui peuvent s'aparier (de la même façon que les deux fibres d'ADN de la double hélice), et seulement en cas d'apariement, c'est à dire, lorsque les deux anticorps ont reconnus la même protéine, la réaction d'amplification par PCR se met en route. Le Proximity Extension Assay d'Olink en est un exemple, et a été utilisé par les trois équipes de Teunissen, Svenningsson et Hansson